
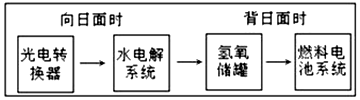
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统将电能转化为化学能 | |
| C. | 水电解系统中的阳极反应:4OH-═2H2O+O2↑+4e- | |
| D. | 燃料电池放电时的负极反应:H2+2OH-═2H2O+2e- |
分析 根据空间站能量转化系统局部示意图,利用水的分解反应和燃料电池中的反应来分析反应中的能量变化,向阳面时,发生的是电解反应,背日面时,发生的是原电池反应.
解答 解:A.由转化图可知,该系统中水既可分解也可生成,是循环使用的,故A正确;
B.燃料电池系统产生的能量来源于所发生的化学反应,燃料电池系统是将化学能转化为电能,故B错误;
C.水电解时,阳极上氢氧根离子失电子生成水和氧气,电极反应式为4OH--4e-=2H2O+O2↑,故C正确;
D.燃料电池放电时,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,故D正确;
故选B.
点评 本题利用信息来考查电解池、原电池的工作原理,难度不大,注重了与生活实际的紧密联系,也体现了利用所学课本知识能够学以致用.


科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| C. | 氢氧化钡溶液与稀硫酸的反应 OH-?+H+=H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
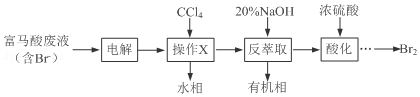
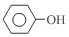 +3Br2→
+3Br2→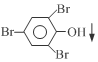 +3HBr
+3HBr查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 磁性氧化铁溶于稀盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性高锰酸钾溶液和硫酸亚铁溶液反应:MnO4-+3Fe2++4H+═MnO2↓+3Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
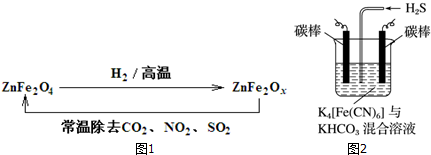
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
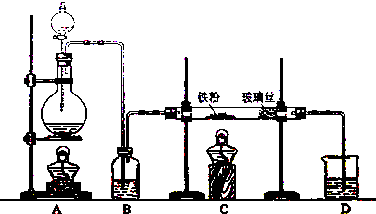
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com