
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
|
组别 |
一元酸 |
NaOH |
pH |
|
甲 |
c(HX)=0.1mol/L |
c(NaOH)=0.1mol/L |
pH=9 |
|
乙 |
c(HY)=c1mol/L |
c(NaOH)=0.1mol/L |
pH=7 |
①甲组实验的混合溶液中离子浓度由大到小顺序为 。由水电离出的c(OHˉ)= mol/L。
②乙组实验中HY为强酸,则HY溶液的c1 (填“<”、“=”或“>”)0.1。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况和n(NO)/n(CO)比例变化情况如下图。

①为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 。
②用CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO2发生反应的化学方程式为 。
(3)工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g)
△H
CH3OH(g)
△H
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
|
温度 |
523K |
573K |
623K |
|
平衡常数(K) |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“<”、“=”或“>”)。
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为 。
③请在下列坐标中画出②中求得该温度下CO、H2和CH3OH的浓度随时间变化的曲线,并进行适当的标注。

(17分)(1)①c(Na+)>c(Xˉ)>c(OHˉ)>c(H+)(2分) 10ˉ5(2分) ②=(1分)
(2)①900K(1分,不写单位或900℃不给分) n(NO)/n(CO)=1(1分,只写1也给分)
②CH4+2NO2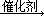 CO2+N2+2H2O(2分,化学式错不给分,系数错扣1分,不写条件不扣分,用等号不扣分)
CO2+N2+2H2O(2分,化学式错不给分,系数错扣1分,不写条件不扣分,用等号不扣分)
(3)①<(2分) ②523K(2分,不写单位或523℃不给分)
③
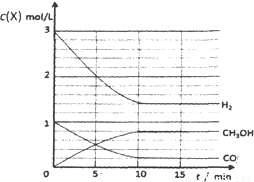
(3分,每条曲线1分,标注错或坐标数值错不给分)
【解析】
试题分析:(1)①HX与NaOH恰好完全中和,所得NaX溶液pH=9,说明NaX是强碱弱酸盐,HX是弱酸;由于电离程度NaX>H2O,前者电离出的Xˉ部分水解,则混合溶液中c(Na+)>c(Xˉ)>c(OHˉ)>c(H+);H2O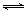 OHˉ+H+,NaX能促进水的电离平衡右移,则水电离出的c(OHˉ)>10ˉ7mol/L,由pH=9可知溶液中c(H+)=10ˉ9mol/L<10ˉ7mol/L,由水的离子积可知,溶液中的c(OHˉ)=Kw/ c(H+)=10ˉ5mol/L>10ˉ7mol/L,所以混合溶液中水电离出的c(OHˉ)=10ˉ5mol/L;②HY是强酸,则NaY是强酸强碱盐,混合溶液pH=7,说明HY与NaOH恰好完全中和,则c(HY)=c(NaOH)=0.1mol/L,所以c1=0.1;(2)①读图可知,相同温度下,n(NO)/n(CO)越大,NO的转化率越小;投料比最小时,温度越高,NO转化率越大,但是 900K时NO转化率已经接近100%,再升高温度,需要消耗更多的能量,NO转化率却增加不大,得不偿失,因此最佳温度和投料比分别为900K、n(NO)/n(CO)=1;②根据题意可知反应产物为CO2、N2、H2O,假设甲烷的系数为1,根据碳、氢、氧、氮原子个数守恒配平可得反应式:CH4+2NO2
OHˉ+H+,NaX能促进水的电离平衡右移,则水电离出的c(OHˉ)>10ˉ7mol/L,由pH=9可知溶液中c(H+)=10ˉ9mol/L<10ˉ7mol/L,由水的离子积可知,溶液中的c(OHˉ)=Kw/ c(H+)=10ˉ5mol/L>10ˉ7mol/L,所以混合溶液中水电离出的c(OHˉ)=10ˉ5mol/L;②HY是强酸,则NaY是强酸强碱盐,混合溶液pH=7,说明HY与NaOH恰好完全中和,则c(HY)=c(NaOH)=0.1mol/L,所以c1=0.1;(2)①读图可知,相同温度下,n(NO)/n(CO)越大,NO的转化率越小;投料比最小时,温度越高,NO转化率越大,但是 900K时NO转化率已经接近100%,再升高温度,需要消耗更多的能量,NO转化率却增加不大,得不偿失,因此最佳温度和投料比分别为900K、n(NO)/n(CO)=1;②根据题意可知反应产物为CO2、N2、H2O,假设甲烷的系数为1,根据碳、氢、氧、氮原子个数守恒配平可得反应式:CH4+2NO2 CO2+N2+2H2O;(3)①根据表中信息推断,升高温度平衡常数减小,前者说明平衡向吸热方向移动,后者说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是△H<0的放热反应;②根据各组分的变化浓度之比等于系数之比,可求平衡浓度:
CO2+N2+2H2O;(3)①根据表中信息推断,升高温度平衡常数减小,前者说明平衡向吸热方向移动,后者说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是△H<0的放热反应;②根据各组分的变化浓度之比等于系数之比,可求平衡浓度:
CO(g) + 2H2(g) 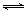 CH3OH(g)
CH3OH(g)
起始浓度/mol•Lˉ1 1 3 0
变化浓度/mol•Lˉ1 0.8 1.6 0.8
平衡浓度/mol•Lˉ1 0 .2 1.4 0.8
K=c(CH3OH)/[c(CO)•c2(H2)]= 0.8/[0 .2×1.42]=2.041
与表中数据对比可知,平衡时温度为523K。
③画图要点:a、起点时,t=0,c(CO)=1mol/L,c(H2)=3mol/L,c(CH3OH)=0;b、平衡点或拐点时,t=10min,c(CO)=0.2mol/L,c(H2)=1.4mol/L,c(CH3OH)=0.8mol/L;c、起点至平衡点或拐点时,反应物浓度逐渐减小,生成物浓度逐渐增大,且各组分的变化浓度之比等于化学方程式中相应的系数之比;平衡点或拐点之后,各组分的浓度保持不变。
考点:考查化学反应原理,涉及酸和碱混合溶液中离子浓度大小关系、盐类水解、水的电离、化学平衡、化学方程式等考点。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH=7 |
| 丙 | c(HZ)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH=b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | c(一元酸)/mol?L-1 |
c(NaOH)/mol?L-1 |
混合溶液的pH |
| HX | 0.1 | 0.1 | pH=x |
| HY | 0.1 | 0.1 | pH=7 |
| HZ | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源:2014届吉林省长春市高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
|
组别 |
一元酸 |
NaOH |
混合溶液的pH |
|
甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
|
乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
|
丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
|
丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a 7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年西藏拉萨中学高三第五次月考理综化学部分 题型:填空题
(每空3分,共12分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
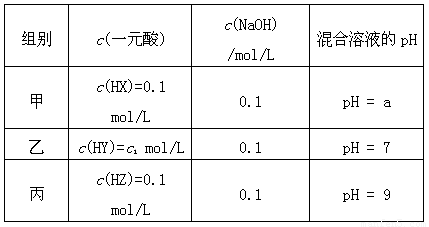
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c(OH-) = mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com