
����Ŀ��ҽ���Ȼ��ƿ������������ơ�������������ҩ��Թ�ҵ̼��ƣ���������Na����Al3����Fe3�������ʣ�����ҽҩ����ˮ���Ȼ��ƣ�CaCl2��2H2O����������Ϊ97.0%~103.0%������Ҫ�������£�

��1�����Ӳ����Ǽ����������ƣ�������Һ��pHΪ8.0~8.5���Գ�ȥ��Һ�е�����Al3����Fe3��������Fe(OH)3�Ƿ������ȫ��ʵ�������________________��
��2���ữ�����Ǽ������ᣬ������Һ��pHΪ4.0����Ŀ���У�������Һ�е�����Ca(OH)2ת��ΪCaCl2������ֹCa2��������ʱˮ�⣻��_______________��
��3���ⶨ��Ʒ��Cl�������ķ����ǣ�a.��ȡ0.7500g��Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b.��ȡ25.00mL����Һ����ƿ�У�c.��0.05000mol��L��1AgNO3��Һ�ζ����յ㣬����AgNO3��Һ�����ƽ��ֵΪ20.39mL��
�������ⶨ������������Һ��ϴ�������У�____________________��
������������Ʒ��CaCl2��2H2O����������Ϊ��____________________��
���������������ⶨ����Ʒ��CaCl2��2H2O����������ƫ�ߣ��ⶨ�����в��������ɺ��ԣ��������ԭ���У�__________��___________��
���𰸡�ȡ�����ϲ���Һ���μ�KSCN��Һ����������Ѫ��ɫ������Fe(OH)3������ȫ ��ֹ��Һ���տ����е�CO2 ��ʽ�ζ��� 99.9% ��Ʒ�д���������NaCl ����CaCl2��2H2O ʧˮ
��������
��1��Fe3+��KSCN��Ӧ���ɺ�ɫ����Fe(SCN)3������Fe3+�Ƿ���ڿ���ѡ��KSCN��Һ���ʴ�Ϊȡ�����ϲ���Һ���μ�KSCN��Һ����������Ѫ��ɫ�������Fe(OH)3������ȫ��
��2��Ca(OH)2�����տ����е�CO2����CaCO3������Ӱ���Ʒ�Ĵ��ȣ��ʴ�Ϊ��ֹ��Һ���տ�����CO2��
��3�����ζ�ʵ���У�����ϴ�������еζ��ܡ���Һ�ܣ���ʵ������ AgNO3��Һ�ζ�����Һ�ģ�������Ҫ��ϴ������һ������ʽ�ζ��ܣ��ʴ�Ϊ��ʽ�ζ��ܣ�
�� ���ݹ�ϵʽ��CaCl2��2H2O ~ 2AgNO3
147 2
����0.7500��25/250 0.05000��0.02039
��ã�����0.9991��99.9%���ʴ�Ϊ99.9%��
�����ݷ�Ӧ��CaCl2��2H2O ~ 2Cl��~ 2AgNO3����Cl��ƫ�࣬��ζ��Ľ���ͻ�ƫ�ߣ�������Ʒ�������к���������CaCl2��NaCl��CaCl2��2H2O �����еĽᾧˮʧȥһ���ֶ���ʹCaCl2��2H2O����������ƫ�ߣ��ʴ�Ϊ��Ʒ�д���������NaCl��������CaCl2��2H2Oʧˮ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ���͵������жϲ���ȷ����
ѡ�� | �л���Ӧ | ��Ӧ���� |
A | ����H2��Ӧ���ɻ����� | �ӳɷ�Ӧ |
B | ������������Ϲ��ձ�ը | ȡ����Ӧ |
C | ��ϩ�����CCl4��Һ��Ӧ | ȡ����Ӧ |
D | ��ϩʹ���Ը��������Һ��ɫ | ������Ӧ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�ںϳɰ���ҵ�У�����NH3����������Ӧ���ʣ����ԭ��ת����
B.�����½��еķ�Ӧ2NO2(g)![]() N2O4(g)��ƽ��ʱ���ݻ��������2mol��NO2�����ٴδﵽƽ��ʱNO2�����������ԭƽ���
N2O4(g)��ƽ��ʱ���ݻ��������2mol��NO2�����ٴδﵽƽ��ʱNO2�����������ԭƽ���
C.�����£�MgO(s)��C(s)��Mg(s)��CO(g)�����Է����У������H��0
D.������pH=2����������H2O�������c(H��)��1.0��10��2mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2002��ŵ������ѧ������ߵĹ���֮һ�Ƿ����˶��л�����ӽ��нṹ�������������䷽�����ü������ģ�10��9g��������ͨ�������ǵ����ӻ���ʹ��Ʒ���Ӵ������ӻ��������������ѳɸ�С�����ӡ���C2H6���ӻ���ɵõ�C2H6����C2H5����C2H4��������Ȼ��ⶨ���ʺɱȡ�ij�л�����Ʒ���ʺɱ�����ͼ��ʾ���������Ӿ���һ����λ����ɣ��ź�ǿ��������ӵĶ����йأ�������л���������� ��
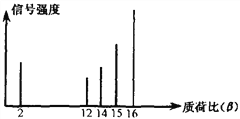

A. �״� B. ���� C. ���� D. ��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ��������ȷ����( )
A. ��֪�����ȼ����Ϊ890.3kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4(g)+2O2(g)�TCO2(g)+2H2O(g)��H=-890.3kJmol-1
B. ��֪C(ʯī��s)�TC(���ʯ��s)��H��0������ʯ��ʯī�ȶ�
C. ��֪�к���Ϊ��H=-57.4kJmol-1����1molϡ���������ϡNaOH��Һ��Ӧ�ķ�Ӧ�Ⱦ����к���
D. ��֪S(g)+O2(g)�TSO2(g)��H1��S(s)+O2(g)�TSO2(g)��H2�����H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ӦX��g��![]() 4Y��g�� +Z��g�� ��H< 0����ij�¶�ʱX��Ũ����ʱ��仯�����ߣ�
4Y��g�� +Z��g�� ��H< 0����ij�¶�ʱX��Ũ����ʱ��仯�����ߣ�

�����йظ÷�Ӧ��������ȷ���ǣ� ��
A. ��6min��Ӧ����ֹ��
B. X��ƽ��ת����Ϊ85��
C. �������¶ȣ�X��ƽ��ת���ʽ�����85��
D. �������¶ȣ�v����v������ͬ��������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�����a mol FeBr2����Һ�У�ͨ��x mol Cl2�����и���Ϊͨ��Cl2�����У���Һ�ڷ�����Ӧ�����ӷ���ʽ�����в���ȷ���� (����)
A. x��0.6a��2Br����Cl2===Br2��2Cl��
B. x��0.4a��2Fe2����Cl2===2Fe3����2Cl��
C. x��a��2Fe2����2Br����2Cl2===Br2��2Fe3����4Cl��
D. x��1.5a��2Fe2����4Br����3Cl2===2Br2��2Fe3����6Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1=+206.1kJ/mol
CO(g)+3H2(g) ��H1=+206.1kJ/mol
��CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H2=+247.3kJ/mol
2CO(g)+2H2(g) ��H2=+247.3kJ/mol
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3=��41.2kJ/mol
CO2(g)+H2(g) ��H3=��41.2kJ/mol
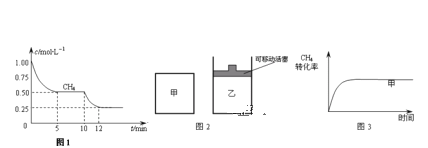
��ش��������⣺
��1����һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5min�ڣ�v (H2)=_____��10minʱ���ı���������������________��
��2����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȣ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䣮��֪��������CH4��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��_____��
��3��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ��____________(�����)��
a��v(��)��v (��) b��v(��)��v (��)
c��v(��)= v (��) d�����жϣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͪ��һ����Ҫ�Ļ���ԭ�ϣ�ʵ���ҳ������з����Ʊ�����ͪ��
![]()
������������ͪ��ˮ�IJ����������ʼ��±���
���� | �е㣨���� | �ܶȣ�g��cm��3��20���� | �ܽ��� |
������ | 161.1��97.8���� | 0.9624 | ������ˮ |
����ͪ | 155.6��95���� | 0.9478 | ����ˮ |
ˮ | 100.0 | 0.9982 |
�������е����ݱ�ʾ���л�����ˮ�γɵľ��й̶���ɵĻ����ķе�
��1������Na2Cr2O7��Һ������������Ӧ����H<0����Ӧ���ҽ�������ϵ�¶�Ѹ������������Ӧ���ࡣʵ���н�����Na2Cr2O7��Һ�ӵ�ʢ�л��������ձ��У���55~60�����з�Ӧ��
��Ӧ��ɺ�������ˮ�������ռ�95~100������֣��õ���Ҫ������ͪ��ˮ�Ļ���
������Na2Cr2O7��Һ�ļ��Ϸ�ʽΪ_______________��
�������ܷ��뻷��ͪ��ˮ��ԭ����_______________��
��2������ͪ���ᴿ��Ҫ��������һϵ�еIJ�����
a. �����ռ�151~156������֣� b. ���ˣ�
c. ���ռ���������м�NaCl ���������ͣ����ã���Һ��
d. ������ˮMgSO4���壬��ȥ�л����е�����ˮ��
��������������ȷ˳����________������ĸ����
����������b��c��ʹ�õIJ����������ձ�����ƿ���������⣬����__________��
������������c������NaCl �����������____________��
��3�����ú˴Ź��������Լ����Ʊ��IJ����Ƿ�Ϊ����ͪ������ͪ��������___�ֲ�ͬ��ѧ��������ԭ�ӡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com