



科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为 _______ 。电解粗铜制取精铜,电解时.阳极材料是 _______ ,电解液中必须含有的阳离子是 _______ 。
(2)在100 mL 18 mol/L浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4< __ mol。
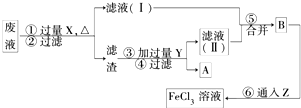
(3)电子工业曾用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重薪得到FeCl3溶液,设计如下实验流程。

上述流程中,所加试剂的化学式为:X _______ ,Y _______ Z _______ ;第⑥步反应的离子方程式为 _______ 。
查看答案和解析>>
科目:高中化学 来源:2013届北京市北师特学校高三第二次月考化学试卷(带解析) 题型:填空题
铜是重要的金属材料.
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为 ,该反应中氧化剂为________ .
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.
上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市高三第二次月考化学试卷(解析版) 题型:填空题
铜是重要的金属材料.
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为 ,该反应中氧化剂为________ .
(2)在100 mL 18 mol·L-1 浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.

上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com