
分析 (1)依据样品过氧化钠质量分数计算过氧化钠的物质的量,依据方程式:2Na2O2+2H2O=4NaOH+O2↑计算生成氧气的物质的量和标况下体积;
(2)依据样品过氧化钠质量分数计算计算碳酸钠的质量分数及物质的量,依据c=$\frac{n}{V}$计算钠离子的物质的量浓度.
解答 解:(1)过氧化钠的物质的量:$\frac{8.86g×88.0%}{78g/mol}$=0.10mol,依据方程式:2Na2O2+2H2O=4NaOH+O2↑,可知生成氧气的物质的量为0.10mol×$\frac{1}{2}$=0.05mol,标况下气体的体积为:0.05mol×22.4L/mol=1.12L;
答:所得气体在标准状况下的体积为1.12L;
(2)样品中含有碳酸钠的物质的量为:$\frac{8.86g×(1-88.0%)}{106g/mol}$=0.01mol,
依据钠原子守恒,反应后溶液中钠离子的物质的量为:(0.10mol+0.01mol)×2=0.22mol,溶液体积为0.5L,所以钠离子的物质的量浓度C=$\frac{0.22mol}{0.5L}$=0.44mol;
答:反应后溶液中Na+的物质的量浓度为0.44mol/L.
点评 本题考查了有关方程式的计算,明确质量分数含义,以物质的量为核心的计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
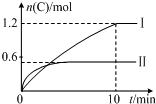 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5mol | 0.5mol | ─ |
| A. | a=-160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10min内平均速率v(B)=0.06mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和O2反应生成水 | B. | 锌片投入稀硫酸中生成H2 | ||
| C. | H2O2分解制取O2 | D. | NH3遇到HCl气体生成白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制2.0 mol•L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为950 mL和201.4 g | |
| B. | 标准状况下,用3.36L HCl气体做喷泉实验完毕后,液体冲入烧瓶的一半(假设实验过程溶液无泄漏),溶液中溶质的物质的量浓度为$\frac{1}{22.4}$mol/L | |
| C. | 向0.1mol•L-1 CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 将溶质相同质量分数分别为3p%的溶液和p%的溶液等体积混合得到质量分数为q%的溶液,则p、q的关系不可能为q>2p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
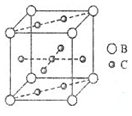 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q .
.| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
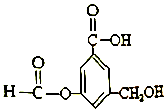
| A. | A 与金属钠完全反应时,两者反应的物质的量之比为1:3 | |
| B. | lmolA最多能与5mol氢气发生反应,反应类型是加成反应 | |
| C. | 1molA与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol | |
| D. | A既能与羧基反应,又能与醇反应,还能发生水解反应和缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com