
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
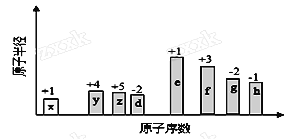
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
【答案】 第三周期ⅢA族 r(O2-)>r(Na+) HClO4>H2SO4 ![]() (或
(或![]()
![]() ) 2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
) 2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
【解析】从图中的化合价和原子半径的大小可以判断出x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。则
(1)f是Al元素,在元素周期表中的位置是第三周期ⅢA族。(2)电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径r(O2-)>r(Na+);非金属性越强最高价氧化物水化物的酸性越强,因此酸性HClO4>H2SO4;(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为![]() 或
或![]() 或
或![]() ;(4)1molNa单质在足量O2中燃烧,放出255.5kJ热量,则2mol钠完全燃烧生成过氧化钠放热是511kJ,因此该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1。
;(4)1molNa单质在足量O2中燃烧,放出255.5kJ热量,则2mol钠完全燃烧生成过氧化钠放热是511kJ,因此该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s) △H=-511kJ·mol-1。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列有关叙述正确的是
A. CH4与P4的分子结构都是正四面体形,因此在NA个CH4分子或P4分子中都含有4NA个共价键
B. 1mol FeI2与足量氯气反应时转移的电子数为2NA
C. 92g NO2和N2O4混合气体中含有的原子数为6NA
D. 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置中,A、F分别为NH3和Cl2的发生装置. 
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)甲、乙两同学分别采用下列两种方案制取C12:甲:用含HCl 146g的浓盐酸与足量的MnO2反应.乙:用87g MnO2与足量浓盐酸反应.则所得氯气(填字母).
a.甲比乙多b.乙比甲多c.一样多
(3)仪器H的名称是(填名称),装置E的作用是 .
(4)装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用进行尾气处理(填选用试剂的名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解池的叙述不正确的是
A.与电源正极相连的是电解池的阴极
B.电解质溶液中的阳离子向阴极移动
C.在电解池的阳极发生氧化反应
D.电子从电源的负极沿导线流入电解池的阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0.5 mol能与1 mol HCl完全加成,加成后的产物分子上的氢原子又可被3 mol Cl2完全取代。则此气态烃可能是( )
A.HC≡CHB.CH2=CH2C.HC≡C-CH3D.CH2=C(CH3)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于_________腐蚀。
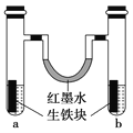
(1)红墨水柱两边的液面变为左低右高,则______(填“a”或“b”)边盛有食盐水。
(2) b试管中铁发生的是______腐蚀,生铁中碳上发生的电极反应式___________。
II.下面两个图都是金属防护的例子。
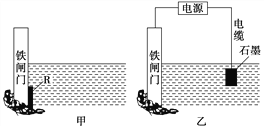
(3)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_____(从下面选项中选择),此方法叫做______________保护法。
A.铜 B.钠 C.锌 D.石墨
(4)图乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的_____极。
(5)采取以上两种方法,_____(填“甲”或“乙”)种能使铁闸门保护得更好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块金属钠,放在燃烧匙里加热,下列实验现象描述不正确的是( )
A. 燃烧后得白色固体B. 燃烧时火焰为黄色
C. 燃烧后生成淡黄色固体物质D. 金属先熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图:

请回答下列问题:
(1)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO![]() )为正极和负极电极反应的活性物质,电池总反应为 V2++VO
)为正极和负极电极反应的活性物质,电池总反应为 V2++VO![]() +2H+
+2H+![]() VO2++V3++H2O。放电时的正极反应式为______________________,充电时的阴极反应式为_____________。
VO2++V3++H2O。放电时的正极反应式为______________________,充电时的阴极反应式为_____________。
(2)钒电池基本工作原理示意图中“正极电解液”可能是________。
a.VO![]() 、VO2+混合液 b.V3+、V2+混合液 c.VO
、VO2+混合液 b.V3+、V2+混合液 c.VO![]() 溶液
溶液
d.VO2+溶液 e.V3+溶液 f.V2+溶液
Ⅱ、氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

(1)图1中N型半导体为__________(填“正极”或“负极”)
(2)该系统工作时,A极的电极反应式为________________
(3)若A极产生7.00gN2,则此时B极产生________L H2(标况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com