
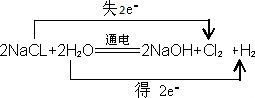

 ;
; ;
;

科目:高中化学 来源: 题型:
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:2012届北京市朝阳区高三上学期期中考试化学试卷 题型:填空题
(13分)氢气是一种清洁能源,可以通过多种方法制得。
(1) 工业上用水煤气法制氢气,有关化学方程式是:
反应一:C( s) + H2O(g)
s) + H2O(g)  CO(g) + H2(g) △H> 0
CO(g) + H2(g) △H> 0
反应二:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
①若反应一在t℃时达到化学平衡状态,则此温度下该反应的的平衡常数表达式
K = ;
②在427℃时将CO 和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状态,该反应的平衡常数是9,则CO的转化率是 ,用CO的浓度变化表示的反应率速v(CO)是 mol /(L·min)。
(2)利用电解饱和食盐水也可制得氢气,下图为电解食盐水的示意图: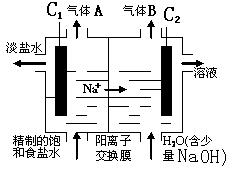
请回答:
① C1电极是 极(填“阴”或“阳”),C2电极的电极反应式是 。
②该电解反应的离子方程式是 ,
(3)通过下列方法也可以得到氢气。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
1molCH4(g)与H2O(g)反应生成CO2(g)和H2(g)的反应热是 kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有 性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有 性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有 性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为 (选填序号);
a.115.2 g b.76.8 g c.57.6 g d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式: 。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com