
分析 (1)酸雨主要是由人为排放的硫氧化物和氮氧化物等酸性气体转化而成的,酸雨的危害是多方面的,可从植被、土壤、建筑、湖泊、水生动植物、工业设备等多方面考虑回答;
(2)在金属活动性顺序中,排在H后面的金属受酸雨破坏的程度较小,此外某些合金耐酸雨的能力也较强;
(3)从氮氧化物和硫氧化物等气体的排放量和气体在雨水中溶解度与季节或温度的关系等方面作答.
解答 解:(1)酸雨主要是由人为排放的硫氧化物和氮氧化物等酸性气体转化而成的,SO2+H2O?H2SO3,2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4,3NO2+H2O=2HNO3+NO,
酸雨的危害:①破坏农作物、森林和草原,使土壤酸性增强.②使湖泊酸化,造成鱼类等死亡.③加速建筑物、桥梁、工业设备,以及电信电缆等物质的腐蚀等,
答:酸雨主要是由人为排放的硫氧化物和氮氧化物等酸性气体转化而成的,酸雨的危害:①破坏农作物、森林和草原,使土壤酸性增强.②使湖泊酸化,造成鱼类等死亡.③加速建筑物、桥梁、工业设备,以及电信电缆等物质的腐蚀;
(2)在金属活动性顺序中,排在氢后面的金属如Cu、Ag等受酸雨破坏的程度较小,因为这些金属不易与酸发生化学反应.此外,合金如不锈钢、铝合金等耐酸雨的能力也较强,
答:不活泼金属Cu、Ag等,不锈钢、铝合金等耐腐蚀的合金;
(3)因为气体的溶解度随温度下降而增大,所以冬天会有较多的SO2和NO2气体溶于雨水,此外,冬天对能量的需求较大,发电厂会燃烧更多的燃料,所以冬天雨水的酸性通常较强,
答:冬天对能量的需求较大,温度低,会有更多的SO2和NO2气体溶于雨水.
点评 本题考查了酸雨的形成和危害,难度不大,环境的污染和治理、环境保护一直是考试中的热点问题,旨在培养学生的环境保护意识.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 酸性:H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
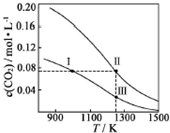 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 化学平衡常数K:K(状态Ⅰ)<K(状态Ⅱ)<K(状态Ⅲ) | |
| B. | CO2的平衡转化率α:α(状态Ⅰ)<α(状态Ⅱ)=α(状态Ⅲ) | |
| C. | 体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 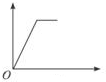 | B. | 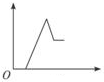 | C. | 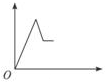 | D. | 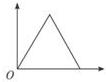 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 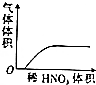 稀HNO3滴入Na2SO3溶液中 | B. | 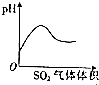 SO2气体通入新制氯水中 | ||
| C. | 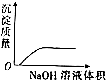 NaOH溶液滴入Ba(HCO3)2溶液中 | D. | 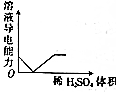 稀H2SO4滴入Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg17Al12是离子化合物 | |
| B. | 为防止金属氧化,熔炼制备Mg17Al12时通氮气做保护气 | |
| C. | 732 g的合金能吸收380.8 L氢气 | |
| D. | 该合金的熔点比镁和铝的熔点低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com