
 电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H1,
电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H1,

科目:高中化学 来源:2012-2013学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:计算题
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
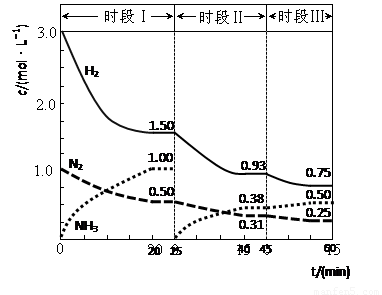
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
△H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g)
△H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)
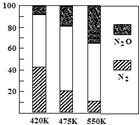
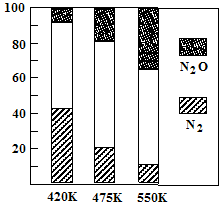
△H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是
,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g)
△H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是
,导致这种规律的原因是 (任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com