
| A. | 氨水稀释后,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 | |
| D. | 对N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
分析 A.氨水溶液中一水合氨在电离平衡,加水稀释促进电离,铵根离子物质的量增加,一水合氨分子减少;
B.碳酸钠溶液中碳酸根离子水解溶液显碱性,加水稀释促进水解正向进行,氢氧根离子浓度减小;
C.反应自发进行的判断依据△H-T△S<0;
D.增大反应物浓度,正逆反应速率都增大.
解答 解:A.氨水溶液中一水合氨在电离平衡,加水稀释促进电离,铵根离子物质的量增加,一水合氨分子减少,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值增大,故A错误;
B.碳酸钠溶液中碳酸根离子水解溶液显碱性,加水稀释促进水解正向进行,氢氧根离子浓度减小,氢离子浓度增大,溶液PH碱性,故B正确;
C.298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,反应前后气体体积减小,△S<0,则满足△H-T△S<0,其△H<0,故C正确;
D.增大反应物浓度,正逆反应速率都增大,对N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率也增大,故D错误;
故选BC.
点评 本题考查了弱电解质电离平衡、盐类水解平衡、化学平衡的影响因素分析,反应自发进行的判断依据等知识点,掌握基础是解题关键,题目难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
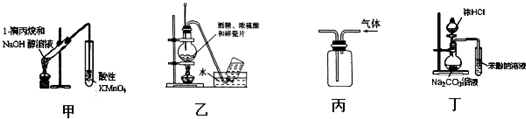
| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 第ⅠA族和第ⅦA族原子化合时,一定生成离子键 | |
| C. | 由非金属元素形成的化合物一定不是离子化合物 | |
| D. | 离子化合物中可能同时含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 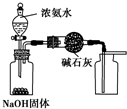 用图所示装置制取干燥纯净的氨气 | |
| B. | 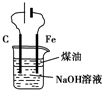 用图所示装置制备并观察氢氧化亚铁的颜色 | |
| C. | 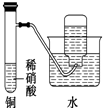 为制备并收集少量NO2气体 | |
| D. |  量取0.10 mol•L-1KOH溶液20.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
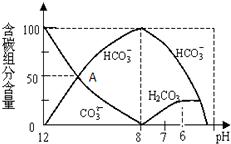 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com