
分析 根据核外电子排布规律可以写出33号元素的核外电子排布式为1S22S22P63S23P63d104S24P3,该元素原子中被电子占据的轨道,s轨道有4个,p轨道有9个,d轨道有5个,所以占据的轨道总共有18个,该原子电子占据的能级有1S、2S、2P、3S、3P、3d、4S、4P总共有8个,由此分析解答.
解答 解:根据核外电子排布规律可以写出33号元素的核外电子排布式为1S22S22P63S23P63d104S24P3,该元素原子中被电子占据的轨道,s轨道有4个,p轨道有9个,d轨道有5个,所以占据的轨道总共有18个,该原子电子占据的能级有1S、2S、2P、3S、3P、3d、4S、4P总共有8个,故答案为:1S22S22P63S23P63d104S24P3,18,8个.
点评 本题考查了原子核外电子排布规律,熟练掌握能量最低原理、泡利不相容原理、洪特规则是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g.mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.32 | 158 |
| 氯化钠 | 0.08 | 58.5 |
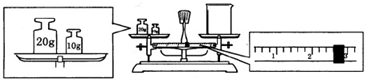
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
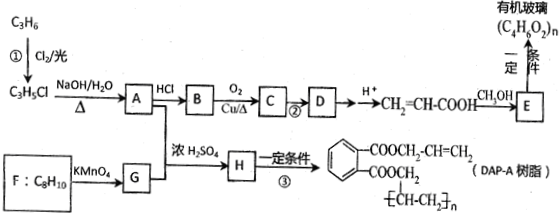
 ;
;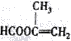 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
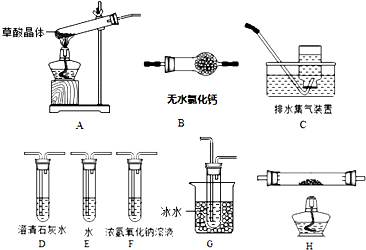
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
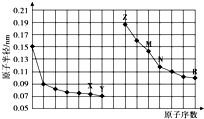
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | X、N两种元素组成的化合物不与任何酸反应 | |
| D. | 简单离子的半径:Z<X<R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com