
下列说法不正确的是()
A. 电解池是将电能转化成化学能的装置
B. 化学键断裂时吸收能量,形成时放出能量
C. 增大反应物的浓度,可增加单位体积内活化分子数,从而使反应速率增大
D. 含0.1molH2SO4的浓硫酸与含0.2molNaOH的溶液混合;放出的热量即为中和热
考点: 常见的能量转化形式;化学反应的能量变化规律;中和热;化学反应速率的影响因素.
分析: A.电解池中电能转化为化学能;
B.断裂化学键需要吸收能量;
C.增加单位体积内活化分子数,使反应速率增大;
D.在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时的反应热叫做中和热.
解答: 解:A.电解池中电能转化为化学能,则电解池是把电能转变为化学能的装置,故A正确;
B.断裂化学键需吸收能量,形成化学键释放能量,故B正确;
C.增大反应物浓度,单位体积的活化分子的数目增大,使反应速率增大,故C正确;
D.反应生成的水不是1mol,故D错误.
故选D.
点评: 本题化学反应的能量变化、化学反应速率、中和热等,难度不大,注意中和热必须是在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时的反应热.


科目:高中化学 来源: 题型:
人体正常的血红蛋白中含有Fe2+,若误服亚硝酸盐会导致Fe2+转化成Fe3+而中毒,服用维C可以解毒,对上述事实分析不正确的是()
A. 亚硝酸盐是氧化剂 B. 维C是还原剂
C. Fe2+被亚硝酸盐氧化 D. 维C被Fe3+还原
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室欲配制0.5mol•L﹣1的NaOH溶液500ml有下列仪器:①烧杯②100ml量筒③1000ml容量瓶④500ml容量瓶⑤玻璃棒⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有填代号,还缺的仪器是,该实验中两次用到玻璃棒,其作用分别是搅拌、.
(2)使用容量瓶之前必须进行的操作是.
查看答案和解析>>
科目:高中化学 来源: 题型:
为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再无机定性分析()
A. Fe B. Si C. Cu D. Na
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
(1)3g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式.
查看答案和解析>>
科目:高中化学 来源: 题型:
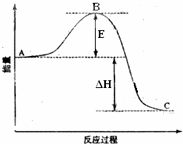
22SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.
已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJ•mol﹣1.请回答下列问题:
(1)图中C表示 ;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是 ;
(2)图中△H= kJ•mol﹣1;
(3)如果反应速率υ(SO2)为0.05mol•L﹣1•min﹣1,则υ(O2)= mol•L﹣1•min﹣1;
(4)已知单质硫的燃烧热为296KJ•mol﹣1,计算由S(s)生成3mol SO3(g)的△H= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com