
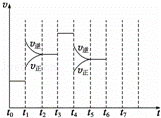
在一密闭容器中发生反应N2+3H2⇌2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是 ACDF (填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 A (填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(3)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线.
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 5:6 .
| 化学平衡状态的判断;化学平衡的影响因素;化学反应速率变化曲线及其应用.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据图示结合v正=v逆,判断是否处于平衡状态; (2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析; (3)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线; (4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,根据三段式和氨气的体积分数计算. |
| 解答: | 解:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,故答案为:ACDF; (2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大, 故答案为:A; (3)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线为:
(4)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3, N2(g)+3H2(g)⇌2NH3(g) 起始 a b 0 转化 x 3x 2x 平衡 a﹣x b﹣3x 2x 则反应后气体总的物质的量=(a+b﹣2x)mol, 故答案为:5:6. |
| 点评: | 本题考查影响化学反应速率的因素,注意把握反应的特点及图象分析是解答的关键,明确温度、压强、催化剂对反应速率的影响即可解答,题目难度不大. |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
某同学帮助水质检测站配制900mL 1 mol·L-1NaOH溶液。
(1)该同学应选择_________mL的容量瓶。
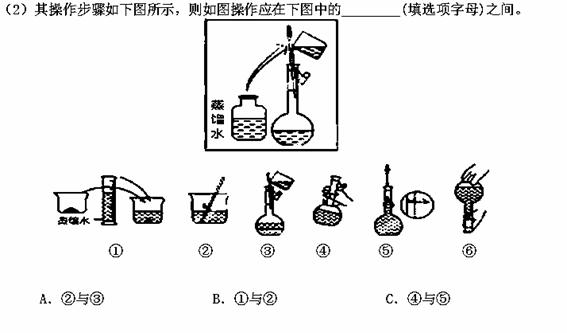
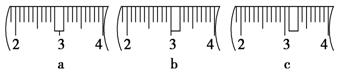
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。
(4)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视读数,浓度会 ;
②转移溶液过程中,少量液体溅出来,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 (填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
 |
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A.纯Ni(s)和Ni(CO)4(g) B.纯Ni(s)和CO(g)
C.不纯Ni(s)和CO(g) D.不纯Ni(s)和Ni(CO)4(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣905.9kJ•mol﹣1,下列叙述正确的是( )
|
| A. | 4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ |
|
| B. | 平衡时v正(O2)=v逆(NO) |
|
| C. | 平衡后减小压强,混合气体平均摩尔质量增大 |
|
| D. | 平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NO2、SO2、等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为 3NO2+H2O=NO+2HNO3 .利用反应6NO2+8NH3 7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.
(2)已知:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1
2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H= ﹣41.8 kJ•mol﹣1.
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 b .
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 溴乙烷(乙醇) | 蒸馏水 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
当有机物分子中的一个碳原子所连四个原子或原子团均不相同时,此碳原子就是“手性碳原子”,具有手性碳原子的物质往往具有旋光性,存在对映异构体,
|
如 等, 下列化合物中存在对映异构体的是
 |
|
 CH3 OH
CH3 OH
 A.C2H5CH===CHCHCH====CHC2H5 B. Cl
A.C2H5CH===CHCHCH====CHC2H5 B. Cl
C.甲酸 D.C6H5COCH3

查看答案和解析>>
科目:高中化学 来源: 题型:
小明血液化验单上“葡萄糖”一项的结果为4.94×10﹣3 mol/L,这里的“4.94×10﹣3 mol/L”表示葡葡糖的( )
|
| A. | 物质的量 | B. | 摩尔质量 | C. | 质量分数 | D. | 物质的量的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
273K,1.01×105pa(标准状况下),将1.40g的氮气,1.60g的氧气和0.40g的氦气混合,该混合气体的体积是( )
A.6.72L B.3.36L C.8.96L D.4.48L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com