
下列反应的离子方程式正确的是( )
A.石英溶于烧碱溶液:SiO2+2OH-=SiO32-+H2O
B.氢氧化钠溶液中通入少量的二氧化硫:SO2+OH-=HSO3-
C.碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.溴化亚铁溶液中通入少量氯气:ZFe2+ +4Br-+3Cl2=2Fe3++2Br2+6Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届山西省等五校高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.原子结构示意图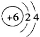 只能表示12C,不能表示14C
只能表示12C,不能表示14C
B.次氯酸的结构式:H-Cl-O
C.NH4Cl的电子式:
D.间硝基甲苯的结构简式: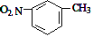
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上开学测化学试卷(解析版) 题型:选择题
如图是某化学反应的微观模拟示意图,下列说法正确的是()
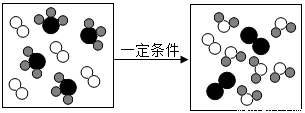
A.该反应属于置换反应 B.反应前后原子种类不变、数目改变
C.反应物中包含两种化合物 D.发生反应的分子个数比为1:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:选择题
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是正极,Ag2O是负极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:选择题
下列说法中,正确的是( )
①食盐灼烧时火焰呈黄色与久置的浓硝酸呈黄色原理不相同
②固体氢氧化钠存放在带塑料塞的广口瓶中
③熔点:钾>钠>钠钾合金
④向紫色石蕊试液中加入过量的Na2O2粉末,振荡后溶液呈蓝色
⑤向含有Na+、SO42-、HCO3-、CO32-的溶液中加入过量的Na2O2固体,Na+和CO32-的物质的量不变
⑥1 mol Na2O2与足量的水反应,转移的电子数为2mol
⑦取用金属钠时,应将剩下的大块钠放回原瓶,实验结束,余下的钠屑应用乙醇处理
A.①②⑦ B .①②③⑥ C .①②⑥⑦ D .①②④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:推断题
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B、A与X均可形成10个电子化合物;B的最高价含氧酸可与其气态氢化物反应生成盐,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液先变红后褪色。
用元素符号或化学式回答下列问题。
(1)X在周期表中的位置是 ;
(2)化合物Y2X2的电子式为 ,它含有的化学键类型有_________(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)X、Z的简单氢化物中沸点较高的是 (填化学式),原因是 。
(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物发生反应可生成Z,其反应的化学方程式为: ;
(5)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为:
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上开学测化学试卷(解析版) 题型:选择题
氮化钠和氢化钠分别与水反应的化学方程式如下:Na3N + 3H2O=3NaOH + NH3↑,
NaH + H2O=NaOH + H2↑。有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na+>N3->H+
B.加热熔化时,都只破坏离子键
C.与盐酸反应都只生成一种盐
D.上述反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上9月调考化学试卷(解析版) 题型:实验题
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。

(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B,打开开关A,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
i滴定过程中发生反应的离子方程式为
ii滴定终点的现象是
iii通过实验数据计算的该产品纯度为 (用字母a,c表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第一次月考化学试卷(解析版) 题型:填空题
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂分别为__________、______________(用离子符号表示),其物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com