
分析 第四周期某元素,其原子失去3个电子后,在1=2的轨道内电子半充满,则3d轨道含有5个电子,失去3个电子时,先失去4s上的2个电子,再失去3d上的1个电子,所以原子的外围电子排布为3d64s2,据此分析.
解答 解:第四周期某元素,其原子失去3个电子后,在1=2的轨道内电子半充满,则3d轨道含有5个电子,失去3个电子时,先失去4s上的2个电子,再失去3d上的1个电子,所以原子的外围电子排布为3d64s2,则该元素原子的电子排布式为1s22s22p63s23p63d64s2,该元素的主量子数为4、原子序数为26、价电子结构为3d64s2,是Fe元素,位于第四周期第VII族;
答:主量子数为4、原子序数为26、价电子结构为3d64s2;第VII族,Fe元素.
点评 本题考查了原子的电子排布、主量子数的判断方法,题目难度不大,侧重于考查学生的分析能力,注意原子在失去电子时先失去4s电子再失去3d电子.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
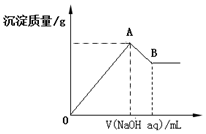 在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.
在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol/L的盐酸500mL,应选用的仪器有胶头滴管、烧杯、玻璃棒、天平、500mL容量瓶 | |
| B. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| C. | 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 | |
| D. | 测定硫酸铜晶体中结晶水含量,加热坩埚中晶体完全失水后需在空气中冷却,再称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 米酒变酸是因为乙醇被氧化为乙酸 | |
| C. | 糖类、油脂、蛋白质都属于天然高分子化合物 | |
| D. | 可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “萃取”实验中,振荡后,需要打开分液漏斗活塞,使漏斗内气体放出 | |
| B. | “浓硫酸稀释”实验中,将水慢慢注入浓硫酸中,并不断搅拌 | |
| C. | “实验室制取氢气”实验中,收集装置与氯气的收集装置相同 | |
| D. | “测定气体摩尔体积”实验中,若温度高于0℃,气体摩尔体积一定大于22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 同一原子中,1s、2s、3s电子能量逐渐减小 | |
| C. | 处于最低能量的原子叫做基态原子 | |
| D. | 同一原子中,2p、3p、4p能级的轨道数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Z2-<W+ | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 甲为含有极性键的离子化合物 | |
| D. | Z的气态氢化物(H2Z)在同族中的稳定性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气中有下列平衡Cl2+H2O?HCl+HClO,当加入AgNO3(s)后溶液颜色变浅 | |
| B. | 2NO2(g)?N2O4(g)△H<0,升高温度可使体系颜色加深 | |
| C. | 反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 | |
| D. | 合成氨反应N2+3H2?2NH3△H<0,使用催化剂加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com