
| A. | 依原电池的原理设计出化学电源 | |
| B. | 原电池是化学电源的雏形 | |
| C. | 原电池输出电能的能力取决于组成原电池的负极材料的活泼性 | |
| D. | 氧化还原反应所释放出的化学能是化学电池的能量来源 |
分析 A、根据原电池将化学能转变成电能的原理,设计化学电源;
B、化学电源是根据原电池原理设计的,故原电池是化学电源的雏形;
C、原电池输出电能的能力与组成原电池的反应物的氧化还原能力和装置设计的合理性等因素有关;
D、化学电源是根据原电池原理设计的,故氧化还原反应所释放出的化学能是化学电池的能量来源.
解答 解:A、根据原电池将化学能转变成电能的原理,设计化学电源,故A正确;
B、化学电源是根据原电池原理设计的,故原电池是化学电源的雏形,故B正确;
C、原电池输出电能的能力与组成原电池的反应物的氧化还原能力和装置设计的合理性等因素有关,发生氧化还原反应的能力越强,输电能力越强,故C错误;
D、化学电源是根据原电池原理设计的,故氧化还原反应所释放出的化学能是化学电池的能量来源,故D正确.
故选C.
点评 本题考查原电池知识,侧重于化学与能量、原电池的工作原理的考查,难度不大,注意基础知识的积累.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
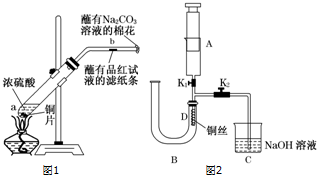
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到上层液体呈紫色 | |
| B. | 液溴有强挥发性,保存时应加少量水液封 | |
| C. | Cl2可以从NaBr水溶液中置换出溴单质,可类推F2可以从NaCl水溶液中置换出氯单质 | |
| D. | HX的还原性顺序为:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
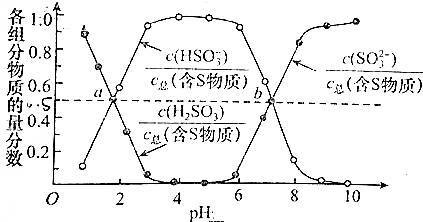
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | v1 | v2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | v3 |
| 水的体积/mL | 15 | 14.5 | v4 | 13.5 |
| 所需时间/min | t1 | t2 | t3 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
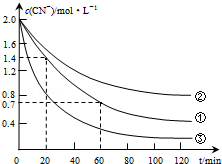
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②⑤ | B. | .①③④ | C. | .③④ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、NO3- | B. | Fe3+、A13+、Cl-、HS- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | K+、Na+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com