
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )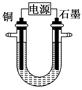
| A.黑色粉末X是铁粉 |
| B.铜电极连接电源正极 |
| C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O |
D.铜的相对原子质量的计算式是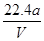 |
科目:高中化学 来源: 题型:单选题
利用如图所示装置可以模拟钢铁的电化学防护。下列说法正确的是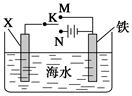
| A.若X为锌棒,开关K置于M处,铁极发生还原反应 |
| B.若X为碳棒,开关K置于N处,X极发生还原反应 |
| C.若X为碳棒,开关K置于N处,可加快铁的腐蚀 |
| D.若X为锌棒,开关K置于M处,可加快铁的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是一套电化学装置,对其有关说法错误的是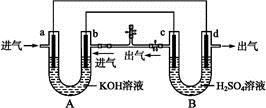
| A.装置A是原电池,装置B是电解池 |
| B.反应一段时间后,装置B中溶液pH增大 |
| C.a口若消耗1 mol CH4,d口可产生4 mol气体 |
D.a口通入C2H6时的电极反应为C2H6-14e-+18OH- 2 2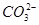 +12H2O +12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融) 4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是
4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是
| A.电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-=Na |
| B.盖·吕萨克法制钠原理是嫡的增加带动了反应的进行 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:1 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
番茄汁显酸性,在番茄上平行地插入铜片和锌片形成一个原电池,如图所示。以下叙述正确的是( )
| A.铜片上发生氧化反应 |
| B.锌片为正极,铜片为负极 |
| C.锌片为阴极,铜片为阳极 |
| D.番茄汁起电解质溶液的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
| A.电子通过盐桥从乙池流向甲池 |
| B.铜导线替换盐桥,原电池仍继续工作 |
| C.开始时,银片上发生的反应是:Ag-e-=Ag+ |
| D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯碱工业的基本原理就是电解饱和食盐水。下列关于实验室电解饱和食盐水的说法中正确的是( )
| A.可以选用石墨棒作为阴、阳极材料,但阳极材料也可以用铁棒 |
| B.用湿润的淀粉KI试纸靠近阴极区域,试纸变蓝 |
| C.电解过程中,在阳极区域溶液中滴加品红,品红褪色 |
| D.实验结束后,将溶液搅拌,然后用pH试纸检验,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 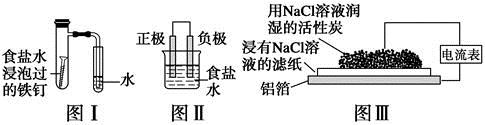
| A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑ |
| D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
体积为1 L的某溶液中含有的离子如表所示:
| 离子 | Cu2+ | Al3+ |  | Cl- |
| | 1 | 1 | a | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com