
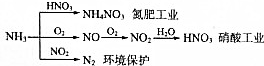
| A. | NH4NO3是常用化肥,在农业上用作棉花、亚麻、大麻、烟草和蔬菜等农作物的肥料,效果特别好 | |
| B. | 硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5 | |
| C. | NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20 | |
| D. | NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化 |
分析 A.硝酸铵含氮量较高;
B.依据硝酸工业中各含氮元素化合物氮元素化合价判断;
C.氨气与二氧化氮发生归中反应生成氮气和水;
D.氨气与硝酸反应生成硝酸铵,没有化合价变化;
解答 解:A.硝酸铵含氮量较高,是很好的氮肥,故A正确;
B.硝酸工业中:NH3→NO→NO2→HNO3,含氮元素化合物氮元素化合价分别是:-3→+2→+4→+5,故B正确;
C.氨气与二氧化氮发生归中反应生成氮气和水,方程式:8NH3+6NO2$\frac{\underline{催化剂}}{△}$7N2+12H20,故C正确;
D.氨气与硝酸反应生成硝酸铵,没有化合价变化,属于非氧化还原反应,故D错误;
故选:D.
点评 本题考查了元素化合物知识,侧重考查氮的氧化物之间的转化,明确氨气的性质是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 3molH2+2molN2 | B. | 4molNH3 | ||
| C. | 2molN2+6molH2 | D. | 1molNH3+0.5molN2+1.5molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
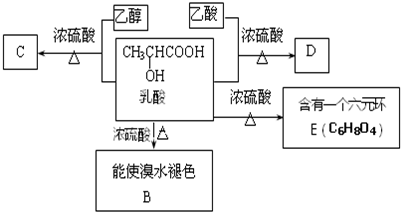
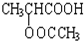 ;
;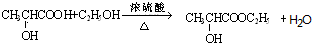 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
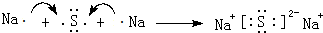
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若3<m<8,则X必定为主族元素 | |
| B. | 若a<b且m=n=4,X、Y不可能形成化合物 | |
| C. | Y的气态氢化物的分子式为H8-nY | |
| D. | 若a=b=3,8>m>n>5,则元素非金属性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | F | G | I | J |
| 化合价 | +1 | -2 | +5、-3 | +4、-4 | +7、-1 | +3 | +2 | +1 |
| 原子半/nm | 0.037 | 0.074 | 0.075 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A、B组成的化合物与A、E组成的化合物中均可能含有非极性共价键 | |
| B. | 离子半径由大到小顺序是F>D>B>J>G | |
| C. | B、J组成的化合物一定属于离子化合物,它与水的反应可能是氧化还原反应 | |
| D. | 工业上生产G、I、J的单质均是通过电解它们的熔融氯化物实现的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com