
| A. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=1:10 | |
| B. | 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka•Kh=Kw | |
| C. | 常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子浓度均降低 | |
| D. | 甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7 |
分析 A、根据混合后显中性,即n(OH-)=n(H+)来分析;
B、利用平衡常数的表达式判断;
C、强酸稀释时c(OH-)增大;
D、如pH之和等于14,等体积混合可等于7.
解答 解:A、某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液中氢氧根的浓度为0.1mol/L,pH=2的硫酸溶液中氢离子的浓度为0.01mol/L,混合后显中性,即n(OH-)=n(H+),故有:0.1mol/L×Va L=0.01mol/L×Vb L,故有:Va:Vb=1:10,故A正确;
B、水解和电离为可逆过程,Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$,Kb=$\frac{c(C{H}_{3}COOH)×c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$;则有Ka•Kh=Kw,故B正确;
C、强酸溶液全部电离,加水稀释后溶液体积增大,溶液中c(H+)减小,水的离子积常数不变,c(H+)减小,则c(OH-)增大,故C错误;
D、当pH之和等于14时,则混合液pH=7,故D正确.
故选C.
点评 本题考查较为综合,涉及弱电解质的电离、pH的计算、盐类的水解以及酸碱混合的定性判断和计算,题目难度中等.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2CH2 | B. | 乙二醇的分子式为:C2H6O2 | ||
| C. | 羟基的电子式为:-O:H | D. | 甲烷分子的比例模型: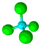 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 反应类型加聚反应.
反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①:除去Cl2中含有的少量HCl | |
| B. | 装置②:构成锌-铜原电池 | |
| C. | 装置③:可用于比较碳酸与苯酚的酸性强弱 | |
| D. | 装置④:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g N2所含有的原子数目为2NA | |
| B. | 室温下,22.4 L的 H2中所含分子数为NA | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 常温常压下,24 g Mg与足量的盐酸完全反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质Cl2、Br2、I2的氧化性强弱 | |
| B. | 气态氢化物NH3、H2O、HF的稳定性 | |
| C. | 碱金属单质Li、Na、K与水反应的剧烈程度 | |
| D. | 1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可用碳在高温下还原二氧化硅制取硅 | |
| B. | 漂白粉的主要成分是次氯酸钙 | |
| C. | 镁条能在二氧化碳气体中燃烧 | |
| D. | 将盛有氢氧化铁胶体的烧杯置于暗处,用一束光照射,从垂直于光线的方向可以观察到一条光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②④① | B. | ③②①④ | C. | ②③①④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com