
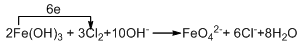 ,故答案为:
,故答案为: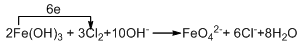 .
.

科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |

| 1 |
| V |
| 1 |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是
Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是查看答案和解析>>
科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c最好是 (填编号)。
A.纯水 B.AgNO3溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前,
对c应作何简单处理? 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年内蒙古巴彦淖尔市中学巴市一中高二上学期12月月考化学试卷 题型:填空题
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。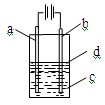
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c最好是 (填编号)。
| A.纯水 | B.AgNO3溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源:2013届内蒙古巴彦淖尔市巴市一中高二上学期12月月考化学试卷 题型:填空题
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。
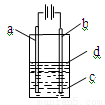
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c最好是 (填编号)。
A.纯水 B.AgNO3溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前,
对c应作何简单处理? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com