
| A、常温下,9g H2O中含NA个O-H键 |
| B、1mol Fe2+与足量稀硝酸反应,转移3NA个电子 |
| C、常温常压下,22.4L SO2和O2的混合气体中含2NA个氧原子 |
| D、0.1mol?L-1 KAl(SO4)2溶液中含0.2NA个SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、B与A只能形成化合物BA3 |
| B、C的原子半径、离子半径均分别小于D的原子半径、离子半径 |
| C、A、B、C形成的化合物可能促进水的电离,也可能抑制水的电离 |
| D、A、D均能与C形成原子个数比为1:1、2:1的化合物,且A2C2与D2C2的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
B、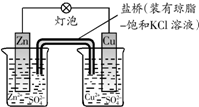 如图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C、氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O |
| D、电镀时,通常把待镀的金属制品作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
| H- |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) |
| B、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 |
| C、常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变 |
| D、c(HCO3-):c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 将一块Na投入CuSO4溶液 | 有沉淀产生 | Na的金属活动性比铜强 |
| C | 盐酸滴入Na2CO3溶液 | 产生气泡 | 氯的非金属性比碳强 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水蒸气在高温下发生了置换反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰熔化时水分子的共价键未发生断裂 |
| B、同族元素的氧化物形成的晶体类型相同 |
| C、分子晶体中,分子间作用力越大,分子越稳定 |
| D、具有高熔沸点的晶体一定是离子晶体或原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C | 确定碳、氯两元素非金属性的强弱 | 测定同温同浓度的Na2CO3和NaClO水溶液的pH |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com