
 CHCl3+HCl �˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4�ȣ���֪CCl4�ķе�Ϊ 77�棬CHCl3�ķе�Ϊ 61.2�森
CHCl3+HCl �˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4�ȣ���֪CCl4�ķе�Ϊ 77�棬CHCl3�ķе�Ϊ 61.2�森| ʵ����� | �¶ȡ� | ��ʼCCl4Ũ�� | ��ʼH2Ũ�� | CCl4��ת���� |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
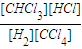 =
=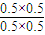 =1���ʴ�Ϊ��1��
=1���ʴ�Ϊ��1�� 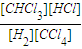 =
=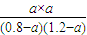 =1������a=0.48mol/L����CCl4��ת����Ϊ
=1������a=0.48mol/L����CCl4��ת����Ϊ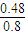 ×100%=60%��50%���ʴ�Ϊ�����ڣ�
×100%=60%��50%���ʴ�Ϊ�����ڣ� 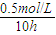 =0.05mol/L?h��
=0.05mol/L?h�� CHCl3+HCl �˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4�ȣ���֪CCl4�ķе�Ϊ 77�棬CHCl3�ķе�Ϊ 61.2�森��Ӧ�������ӵķ�Ӧ���ƶϷ�Ӧ�Ƿ��ȷ�Ӧ�������¶�110°C���͵� 100°C��ƽ��������У�CCl4ת���ʴ���50%��
CHCl3+HCl �˷�Ӧ�����и���Ӧ��������CH2Cl2��CH3Cl��CH4�ȣ���֪CCl4�ķе�Ϊ 77�棬CHCl3�ķе�Ϊ 61.2�森��Ӧ�������ӵķ�Ӧ���ƶϷ�Ӧ�Ƿ��ȷ�Ӧ�������¶�110°C���͵� 100°C��ƽ��������У�CCl4ת���ʴ���50%��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� |
| �� |
| ʵ����� | �¶ȡ� | ��ʼCCl4Ũ�ȣ�mol?L-1�� | ��ʼH2Ũ�ȣ�mol?L-1�� | CCl4��ת���� |
| 1 | 110 | 0.8 | 1.2 | a |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 2 | x |
| 4 | 120 | 1 | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�� ��� |
�¶ȡ� | ��ʼCCl4Ũ�� ��mol?L-1�� |
��ʼH2Ũ�ȣ�mol?L-1�� | CCl4��ƽ��ת���� |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ����� | �¶ȡ� | ��ʼCCl4Ũ�ȣ�mol/L�� | ��ʼH2Ũ�ȣ�mol/L�� | CCl4��ƽ��ת���� |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
| c(CHCl3)?c(HCl) |
| c(CCl4)?c(H2) |
| c(CHCl3)?c(HCl) |
| c(CCl4)?c(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ�� ��� |
�¶ȡ� | ��ʼn��CCl4�� ��mol�� |
��ʼn��H2�� ��mol�� |
ƽ��ʱn��CHCl3�� ��mol�� |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| �� |
| ʵ����� | �¶ȡ� | ��ʼCCl4Ũ�ȣ�mol?L-1�� | ��ʼH2Ũ�ȣ�mol?L-1�� | CCl4��ת���� |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
| [CHCl3][HCl] |
| [H2][CCl4] |
| [CHCl3][HCl] |
| [H2][CCl4] |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com