
| A. | 用广泛pH试纸测得某溶液的pH为3.5 | |
| B. | 用25mL量筒量取12.36mL盐酸 | |
| C. | 用托盘天平称量8.7g食盐 | |
| D. | 将40 g NaOH溶解于1 L 水中配得1 mol•L-1的溶液 |
分析 A.广泛pH试纸的精确度只能达到1;
B.量筒精确到0.1mL;
C.托盘天平精确到0.1g;
D.溶液的体积不是1L.
解答 解:A.广泛pH试纸的测定的pH为正整数,无法测得某溶液pH为3.5,故A错误;
B.量筒的精确度只能达到0.1mL,不能读到12.36ml,故B错误;
C.托盘天平精确到0.1g,可称量8.7g食盐,故C正确;
D.40gNaOH的物质的量为1mol,溶于水配成1L溶液浓度为1mol•L-1,不是溶剂的体积为1L,故D错误.
故选C.
点评 本题考查化学实验常用仪器,难度不大,解答本题的关键是记住量筒、广泛pH试纸以及托盘天平的准确度,只要记住了准确度,就能很容易地判定所给出数据的合理性.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题
 钢化玻璃是一类性能良好的玻璃,它可以克服玻璃质脆易碎的缺点.离子交换法是玻璃进行钢化的一种重要方法.将普通的钠钙玻璃在碳酸钾的强化盐(475℃)中浸泡3.5小时后即可制得.下图是离子交换法的示意图.
钢化玻璃是一类性能良好的玻璃,它可以克服玻璃质脆易碎的缺点.离子交换法是玻璃进行钢化的一种重要方法.将普通的钠钙玻璃在碳酸钾的强化盐(475℃)中浸泡3.5小时后即可制得.下图是离子交换法的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Na+、Ca2+、Cl-、NO3- | D. | Ag+、Cu2+、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是一种光学现象 | |
| C. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | |
| D. | 缓解旱情的措施之一是可以用干冰或碘化银进行人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
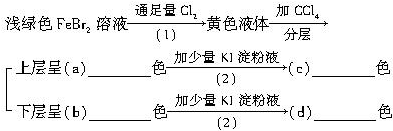
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 18 g D2O含有NA个质子 | |
| D. | 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com