


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
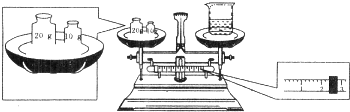 实验室欲配制0.5mol/LNaOH溶液500mL.
实验室欲配制0.5mol/LNaOH溶液500mL.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
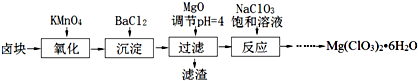
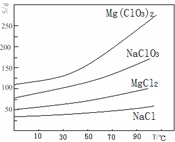
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 实验 | 现象 | 离子方程式 | |
| A |  K2SO4 K2SO4Kl淀粉溶液 | 在空气里放置一段时间后溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B |  稀盐酸 稀盐酸稀碳酸钠溶液 | 开始时无气泡,后来有气泡 | CO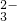 +H+═HCO +H+═HCO HCO 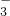 +H+═H2O+CO2↑ +H+═H2O+CO2↑ |
| C |  NaOH溶液 NaOH溶液Cl2水 | 溶液由黄绿色变为无色 | Cl2+2OH-═Cl-+ClO-+H2O |
| D |  H2SO4加有酚酞的 H2SO4加有酚酞的Ba(OH)2溶液 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
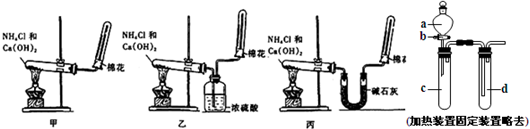
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
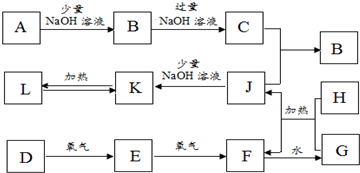
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
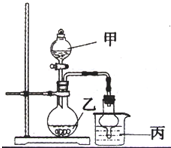 如图所示实验装置进行实验(必要时可以进行加热),下列实验现象描述不正确的是
如图所示实验装置进行实验(必要时可以进行加热),下列实验现象描述不正确的是| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | H2O2 | MnO2 | FeCl2 | 溶液由浅绿色变为棕黄色 |
| B | 浓氨水 | CaO | AgNO3 | 开始有白色沉淀生成,随后白色沉淀减少以至完全消失 |
| C | H2SO4 | Na2SO3 | BaCl2 | 产生白色沉淀 |
| D | 浓HNO3 | Cu | NaHCO3 | 有无色气体生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com