
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量乙炔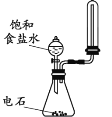
B. 制取并检验乙烯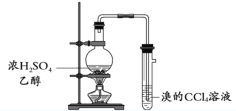
C. 检验溴乙烷与NaOH乙醇溶液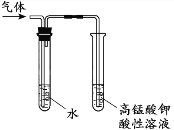
D. 制取并提纯乙酸乙酯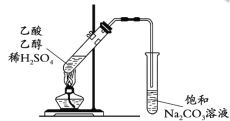
【答案】C
【解析】
A. 乙炔难溶于水,密度比空气略小;
B. 可能有二氧化硫等杂质气体产生干扰乙烯的检验;
C. 溴乙烷与NaOH乙醇溶液反应生成乙烯;
D. 制取乙酸乙酯时需用浓硫酸作催化剂。
A. 乙炔的相对分子质量为26,空气的平均分子质量为29,则乙炔的密度与空气相差不大,收集时应用排水法收集,故A项错误;
B. 实验室用浓硫酸与乙醇制备乙烯时需控制温度在170![]() ,且产生的乙烯气体中可能含有二氧化硫,二氧化硫也可使溴的四氯化碳溶液褪色,则不能达到实验目的,故B项错误;
,且产生的乙烯气体中可能含有二氧化硫,二氧化硫也可使溴的四氯化碳溶液褪色,则不能达到实验目的,故B项错误;
C. 溴乙烷与NaOH乙醇溶液共热可产生乙烯,其反应方程式为:CH3CH2Br +NaOHNaBr + CH2=CH2![]() + H2O,因乙醇易挥发,产生的气体中可能有乙醇蒸汽,故实验装置中先将气体通入水中除去乙醇气体,排除干扰,再通过酸性高锰酸钾溶液,若褪色,则证明有乙烯生成,故C项正确;
+ H2O,因乙醇易挥发,产生的气体中可能有乙醇蒸汽,故实验装置中先将气体通入水中除去乙醇气体,排除干扰,再通过酸性高锰酸钾溶液,若褪色,则证明有乙烯生成,故C项正确;
D. 实验室制备乙酸乙酯所用原料为乙酸、乙醇和浓硫酸,故该装置不能达到实验目的,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.碳酸钙与醋酸溶液反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C.200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:
4Fe2+ + 6Br-+ 5Cl2 == 4Fe3+ + 3Br2 + 10Cl-
D.Na2S的水解:S2- + 2H2O ![]() H2S + 2OH-
H2S + 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:
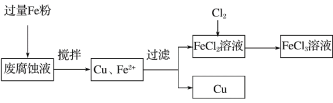
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是________(填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为__________________________________。
(3)如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。

实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是__________________________________。
(4)按上述流程操作,需称取Fe粉的质量应不少于________ g(精确到0.1 g),需通入Cl2的体积不少于________ L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂标签上的部分内容,据此下列说法正确的是( )

A.该硫酸试剂的物质的量浓度为18.4mol·L-1
B.该硫酸可以干燥H2S等酸性气体,但不可以干燥NH3
C.50mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46mol
D.2.7gAl与足量的该硫酸反应可得到H23.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钾的冶炼可采用如下方法:2KF+CaC2![]() CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
实验目的:通过实验证明煤中含有碳元素和硫元素。
查阅资料:
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:___。
( )SO2+( )MnO4-+( )=( )+( )Mn2++( )
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
实验探究:甲同学:甲同学进行了如图所示A、B两步实验:

“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是___:
实验探究:丙同学:丙同学进行了如图所示实验(部分装置在图中略去):

(3)图C装置的作用是___。
(4)证明煤中含有碳元素和硫元素的现象是:___。
(5)装置C中的高锰酸钾溶液也可以替换为___。
A.足量I2的淀粉溶液
B.足量饱和NaHCO3溶液
C.足量Na2SO3溶液
D.足量溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______。
(2)W与Y可形成化合物W2Y,该化合物的电子式为____。
(二)A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:

(3)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式_____。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是_____。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物分子中的碳碳双键发生臭氧氧化反应: ,有机物A的结构简式为
,有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:

(1)下列说法正确的是 ______ 。(填字母序号)
A.C的官能团为羧基
B.1molA最多可以和2molNaOH反应
C.C可以发生氧化反应、取代反应和加成反应
D.![]() 可以发生消去反应
可以发生消去反应
(2)F的结构简式为____________ ,由F到G的反应类型为___________ 。
(3)反应①的作用是__________________ ,合适的试剂a为____________。
(4)同时满足下列条件的A的一种同分异构体的结构简式______________________。
Ⅰ.与A具有相同的官能团;Ⅱ.属于苯的邻二取代物;Ⅲ.能使FeCl3溶液显色;Ⅳ.核磁共振氢谱分析,分子中有8种不同化学环境的氢原子。
(5)H与G分子具有相同的碳原子数目,且1molH能与足量的新制银氨溶液反应生成4mol单质银。写出H与足量的新制银氨溶液反应的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com