
 CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

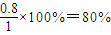 ,此时平衡常数为k=
,此时平衡常数为k=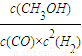 =
=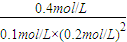 =100(mol/L)-3,温度小于250℃,
=100(mol/L)-3,温度小于250℃, ×②-
×②- ×①可得甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式
×①可得甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式

科目:高中化学 来源: 题型:阅读理解
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源:2014届云南省昆明市高三上学期第一次摸底调研测试化学试卷(解析版) 题型:填空题
甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表:

(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出 、
、 与
与 之间的关系,
之间的关系, =______用
=______用 、
、 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻, 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)=
若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。

(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
A.容器中总压强不变
B.混台气体的平均摩尔质量也始终保持不变,
C.混合气体的密度不变
D.CO2(g)或CO(g)的浓度不变
(5)一定条件下甲醇与一氧化碳反应可合成醋酸。室温下,将a mol/L醋酸溶液与bmol/LNaOH溶液等体积混合。若溶液显中性,则a_________b(选填“>”“<”“=”)。若c(Na+)<c(CH3COO-),则溶液显____性(选填“酸”“碱…中”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省开封市高三第二次质量检测理综化学试卷(解析版) 题型:简答题
甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。

在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
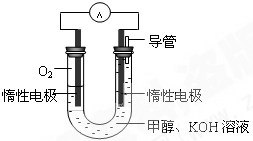
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种 污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。

①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源:宁夏自治区模拟题 题型:填空题
 CH3OH(g) △H1
CH3OH(g) △H1  CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2 

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com