
【题目】下列关于元素及化合物的叙述,正确的是
A. 所有细胞中水占鲜重百分比都一样
B. O是构成细胞的大量元素之—,在人体细胞的干重中含量最多
C. 水是占细胞鲜重百分比最大的化合物
D. 构成细胞的任何一种化合物都能在无机自然界找到
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
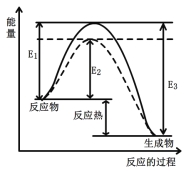

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 _______(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 _____(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。请回答下列问题。

(1)铜和浓硫酸反应中浓硫酸的作用为______________。
(2)B 瓶中盛有品红溶液,观察到品红溶液褪色,这是因为SO2具有_______,C 瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有_________。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,该反应的主要产物的化学式为________。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入____________
A .HNO3 B .NaNO3 C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为合成1 一丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
CO的制备原理:HCOOH![]() CO+H2O,并设计出原料气的制备装置(如图)。
CO+H2O,并设计出原料气的制备装置(如图)。

请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式:_______________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_______________(填序号)
① 饱和Na2SO3溶液② 酸性KMnO4溶液③ 石灰水④ 无水CuSO4 ⑤ 品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_____________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:① RCHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为_________,操作1为__________,操作2为__________,操作3为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,滴加KSCN溶液时无明显现象发生,再滴入少量氯水,溶液立即显红色。则原溶液中一定含有的是( )
A. Fe2+ B. Fe3+ C. K+ D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接________;________接_______;b接_________(填接口编号)。

(2)A中常选用的固体反应物为_______________;D中应选用的液体为________________。
(3)第二步中让___________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________;装有无水CaCl2的U形管的作用是_________________________。
(5)第三步分离出NaHCO3固体的操作是________________。
(6)第四步中所加固体粉末化学式为 。所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A.图1所示,从能量角度考虑,石墨比金刚石稳定
B.图2表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
C.图3所示,图中的阴影部分面积的含义是(v正-v逆)
D.图4表示0.001 mol·L-1盐酸滴定0.001 mol·L-1NaOH溶液的滴定曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com