
| A. | 4种 | B. | 3种 | C. | 6种 | D. | 5种 |
科目:高中化学 来源: 题型:多选题
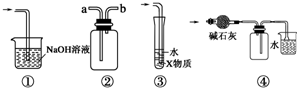
| A. | 装置①可用于吸收实验中多余的Cl2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、HCl、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④中可用于收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | B. | 最高价氧化物对应水化物酸性:R>W | ||
| C. | X与W形成的是离子化合物 | D. | 气态氢化物的热稳定性:Y>R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的无色溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| B. | 使甲基橙变红的溶液中:Na+、HCO3-、Cl-、NO3- | |
| C. | 在有大量MnO4-溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 投入Al有氢所放出的溶液中:Na+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
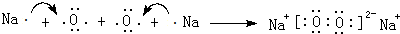 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=11的NaOH和pH=11的KCN溶液中,水的电离程度相等 | |
| B. | 常温下,往Fe(OH)3悬浊液中分别加入少量NaClO、NH4Cl溶液,的溶解度都增大 | |
| C. | NH4Fe(SO4)2溶液中离子浓度关系:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | |
| D. | 10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合后:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |
| 空 | 空 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com