
分析 一水合氨与氯化氢恰好反应生成氯化铵,铵根离子部分水解,则c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知c(NH4+)<c(Cl-);
等体积、等浓度的NH3•H2O和HCl恰好完全反应至中性,则氢离子与氢氧根离子浓度相等,结合电荷守恒判断溶液中各离子浓度大小.
解答 解:等体积、等浓度的NH3•H2O和HCl恰好完全反应,反应后溶质为氯化铵,铵根离子部分水解,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知c(NH4+)<c(Cl-),则溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
等体积、等浓度的NH3•H2O和HCl恰好完全反应至中性,则c(H+)=c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知c(NH4+)=c(Cl-),则溶液中离子浓度大小为:c(Cl-)=c(NH4+)>c(H+)=c(OH-);
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);c(Cl-)=c(NH4+)>c(H+)=c(OH-).
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题
| a与b的关系 | 剩余气体的成分 | 剩余气体物质的量 |
| 若a=b | ||
| 若a>b | ||
| 若a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 原子中均含22个中子 | |
| B. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 组成的金属钛单质互称同分异构体 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 在周期表中位置相同,都在第四周期 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
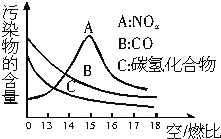 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氧和液氢最好在临发射前的一段时间加注 | |
| B. | 氢气可由电解水获得 | |
| C. | 燃烧产物对发射环境没有污染 | |
| D. | 氢是一次能源,可以自己产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
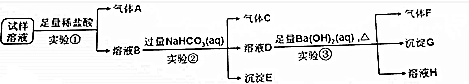
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Cl-、AlO2- | B. | Ba2+、NO3-、HCO3-、Br- | ||
| C. | Cu2+、K+、S2-、SO42- | D. | K+、SO32-、NO3-、MnO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com