
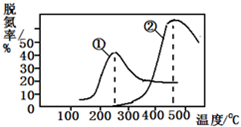
 ��ҵ�ϲ���NH3����ԭ���ѵ�ԭ��Ϊ��NO��g��+NO2��g��+2NH3��g��?2N2��g��+3H2O��g����������һ��������ͨ����������ͬ�¶����ݳ������е������ﺬ�����Ӷ�ȷ������Ч�ʣ���ͼ�����ֲ�ͬ�������ѵ�Ч�����ߣ��ж����·�����ȷ���ǣ�������
��ҵ�ϲ���NH3����ԭ���ѵ�ԭ��Ϊ��NO��g��+NO2��g��+2NH3��g��?2N2��g��+3H2O��g����������һ��������ͨ����������ͬ�¶����ݳ������е������ﺬ�����Ӷ�ȷ������Ч�ʣ���ͼ�����ֲ�ͬ�������ѵ�Ч�����ߣ��ж����·�����ȷ���ǣ�������| A��������Ӧ������ӦΪ���ȷ�Ӧ | B�������١��ڷֱ��ʺ���250���450�������ѵ� | C�����ߢ١�����ߵ��ʾ��ʱƽ��ת������� | D����ͬ�����£��ı�ѹǿ���ѵ���û��Ӱ�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| �Լ������� | �����Լ���g�� | NH3�����mL�� | |
| a | 12.0g Ca��OH��2 �������� | 10.8g NH4Cl | 2688 |
| b | 10.8g ��NH4��2SO4 | 2728 | |
| c | 12.0g NaOH �������� | 10.8g NH4Cl | 3136 |
| d | 10.8g ��NH4��2SO4 | 3118 | |
| e | 12.0g CaO �������� | 10.8g NH4Cl | 3506 |
| f | 10.8g ��NH4��2SO4 | 3584 | |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �й����ʵ����ʵ���/mol | n��NO�� | n��H2O�� |
| �¶�T1 | 1.6 | 2.4 |
| �¶�T2 | 1.2 | 1.8 |
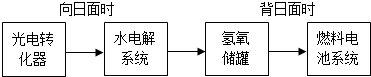
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |
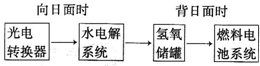
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com