
【题目】下列化学反应的离子方程式书写不正确的是
A. 用FeCl3溶液腐蚀印刷线路板上的Cu:2Fe3++Cu=2Fe2++Cu2+
B. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 稀硝酸中加入过量铁粉: Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 用Na2CO3溶液浸泡锅炉水垢:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
【答案】C
【解析】A项,Cu与FeCl3溶液发生氧化还原反应生成FeCl2和CuCl2,根据离子方程式书写方法,离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故A正确;B项,向CuSO4溶液中加入Na2O2,发生反应:2Na2O2+2H2O=4NaOH+O2↑、2NaOH+CuSO4=Cu(OH)2+Na2SO4,总反应为:2Na2O2+2H2O+2CuSO4=2Cu(OH)2+2Na2SO4+O2↑,离子方程式为:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2+O2↑,故B正确;C项,稀硝酸中加入过量铁粉生成硝酸亚铁、NO和H2O,离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故C错误;D项,工业上用Na2CO3溶液浸泡锅炉水垢使其中的CaSO4转化为更难溶的CaCO3,属于沉淀的转化,离子方程式为:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq),故D正确。
CaCO3(s)+SO42-(aq),故D正确。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】工业制玻璃时,发生的主要反应的化学方程式为: ![]()
![]()
![]()
完成下列填空:
(1)钠原子核外具有______种不同能量的电子,钠元素在周期表中的位置为____________。
(2)在上述反应中,反应物和生成物的晶体类型共有_____种,写出气体产物的电子式_______________。
(3)上述物质中的非金属元素原子半径由大到小顺序为___________(用元素符号表示),下列能判断它们的非金属性强弱的依据是:________(选填编号)。
a. 气态氢化物的熔沸点 b. 最高价氧化物对应水化物的酸性
c. 气态氢化物的热稳定性 d. 三种元素两两形成的化合物中电子对偏向
(4)常温下,相同物质的量浓度的![]() 和
和![]() 溶液中,
溶液中, ![]() _____
_____ ![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)向10mL一定浓度的![]() 溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原
溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原![]() 溶液的物质的量浓度为__________。在滴入盐酸的整个过程中,溶液中
溶液的物质的量浓度为__________。在滴入盐酸的整个过程中,溶液中![]() 的变化情况是______________。
的变化情况是______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是用途广泛的金属元素.
(1)工业生产过程中易产生有害的含铬废水,含铬废水中存在下列平衡:Cr2O72﹣(橙色)+H2O2CrO42﹣(黄色)+2H+ . 处理该废水常用还原沉淀法,其流程如图所示.
已知:Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Cr(OH)3]=6.0×10﹣31
含铬废水 ![]() 含Cr2O
含Cr2O ![]() 的沸水
的沸水 ![]() 含Cr3+的沸水
含Cr3+的沸水 ![]() Cr(OH)3沉淀
Cr(OH)3沉淀
①Cr2O72﹣中铬元素化合价为 .
②第I步转化控制溶液的pH=2,该溶液显色.
③第Ⅲ步沉淀反应后,溶液中c(Fe3+)=2.0×10﹣12 molL﹣1 , 则c(Cr3+)=molL﹣1 .
(2)室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示.
①用离子方程式表示Na2CrO4溶液中的转化反应 .
②根据A点数据,计算该反应的平衡常数值为 . 由图可知,溶液酸性增强,CrO42﹣平衡转化率(填“增大”“减小”或“不变”).
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H0(填“大于”“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小苏打是一种常用的食品添加剂。
(1)精制食盐是制备小苏打的原料之一。粗盐中含有少量Ca2+、Mg2+、SO42-,粗盐精制的步骤顺序是:溶解→ → → → (填字母编号)。_____________
a.加盐酸调pH b.加Ba(OH)2溶液 c.加Na2CO3溶液 d.过滤
(2)NH3、CO2先后通入饱和食盐水中,反应的离子方程式________________。
(3)侯氏制碱法中,母液的处理方法是通入氨气,再加入细小食盐颗粒,最后冷却析出的副产品是_______;简述通氨气的作用____________________________________。
(4)称取2.640 g小苏打样品(含少量NaCl),配置成250 mL溶液,准确取出20.00 mL溶液于锥形瓶中,滴加_______作指示剂,滴定时消耗0.1000 mol/L盐酸的体积为20.67 mL。则该样品中碳酸氢钠的质量分数为_________(保留两位小数)。若装标准溶液的滴定管没有润洗,则测得的结果会____(填“偏大”、“偏小”或“不变”)。
(5)测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。实验需使用的定量仪器是_____;写出涉及的化学方程式__________________。
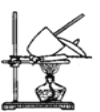
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上还可在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)△H
(1)判断反应达到平衡状态的依据是 .
A.2v(H2)(逆)=v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(2)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 . 若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.用银氨溶液检验某病人是否患糖尿病
B.酶不属于蛋白质
C.在植物油中滴入溴水,溴水褪色
D.在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,元素组成都相同的一组是( )
A. 糖原、胰岛素、纤维素 B. 磷脂、核糖核酸、脱氧核糖
C. 淀粉、乳糖、脂肪 D. 抗原、抗体、血红蛋白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B.甲烷是正四面体结构
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3,还是CCl4,都属于取代反应
D.甲烷的四种取代物常温下均为液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com