
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 试剂 | 物质 | 试剂 |
| CuO(Al2O3) | FeCl3溶液(FeCl2) | ||
| NaHCO3溶液(Na2CO3) | Fe(Al) | ||
| C02(HCl) | Cu(Zn) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2和H2的混合气体 |
| B、0.05molH2 |
| C、大于0.05molH2 |
| D、小于0.05molH2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 1 mol?L-1的FeCl3溶液中含有NA个Fe3+ |
| B、标准状况下,22.4 L己烷中共价键数目为19NA |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、常温常压下的33.6 L氯气与27 g铝反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
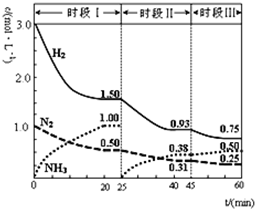 N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )| A、前20分钟反应内放出的热量为46.2kJ |
| B、第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强 |
| D、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | A是形成化合物种类最多的元素之一 |
| ② | B元素原子核外各能级所排电子数相同 |
| ③ | D是地壳中含量最多的元素 |
| ④ | E在常温下能与水剧烈反应产生A单质 |
| ⑤ | F是日常生活中最常用的金属之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com