
| A. | 原子核外的各个电子层最多能容纳的电子数是2n2个 | |
| B. | 原子核外的每个电子层所容纳的电子数都是2n2个 | |
| C. | 原子的最外层由1~2个电子的元素都是活泼的金属元素 | |
| D. | 非金属元素原子最外层数目都大于4 |
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | ②、④两溶液相比,两者的kw相同 | |
| B. | 四种溶液分别加水稀释10倍,pH变化最大的是①和④ | |
| C. | ①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小 | |
| D. | ①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3)最少 | B. | (3)最多 | C. | 都一样多 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=-K2 | B. | K1=K2 | C. | K1=$\frac{1}{{K}_{2}}$ | D. | K1=$\frac{1}{2}$K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{△}^{H_{2}SO_{4}(浓)}$Cu(NO3)2 | B. | Cu$→_{△}^{空气}$CuO$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | D. | Cu$\stackrel{HNO_{3}(浓)}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 0.89 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 、②⑤
、②⑤ 、③⑦
、③⑦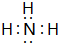
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物在社会生产、生活中起着非常重要的作用.
有机物在社会生产、生活中起着非常重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com