

据此回答:
(1)化合物F是___________。
(2)化合物I是___________。
(3)反应④的化学方程式___________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2010?大连二模)下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:
(2010?大连二模)下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||


查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市高三教学质量测评(二)理综化学试卷(解析版) 题型:推断题
兔耳草醛 是一种重要的香料。用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:
是一种重要的香料。用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:

已知:

试回答下列问题:
(1)兔耳草醛的分子式是 ,物质A的结构简式是 ;
(2)检验C中含有的碳碳双键所用试剂是 (单选);
A.酸性KMnO4溶液 B.新制备Cu(OH)2悬溶液 C.溴水 D.溴的CCl4溶液
(3)C→D的反应类型是: ,其反应的化学方程式为:
(注明反应条件);
(4)兔耳草醛中的含氧官能团易被氧化,生成化合物W,化合物W的结构简式是 。
(5)有机物I有多种同分异构体,其中一类同分异构体能使FeCl3溶液显紫色,结构中不含 —CH3,且苯环上只有两个互为对位的取代基,其可能的结构简式为 (写出一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
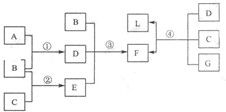 下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:
下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
对于氮元素形成的单质,除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等。其中高聚氮是在高压下通过氮气的聚合形成的,晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构;N4分子结构如图所示。已知断裂N4分子中1molN―N吸收167kJ热量,断裂其它分子中1molN―N吸收193kJ热量,生成1molN≡N放出942kJ热量。根据以下信息和数据,回答下列问题:
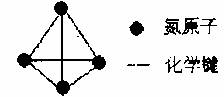
(1)N70的摩尔质量为 。
(2)N4、N60、N70、高聚氮形成晶体时,熔沸点最高的是 。
(3)N4、N60、N70、高聚氮中,最不稳定的可能是 。
(4)1molN4气体转变为N2将 (填“吸收”或“放出”) kJ热量。
(5)原子数相同,电子总数相同的分子互称为等电子体。仅由第二周期元素形成的分子中,互为等电子体的是 和 ;
和 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com