

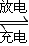 3Zn(OH)2+2Fe(OH)3+4KOH,写出该电池充电时阳极电极反应式______.
3Zn(OH)2+2Fe(OH)3+4KOH,写出该电池充电时阳极电极反应式______.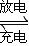 3Zn(OH)2+2Fe(OH)3+4KOH,原电池的负极发生氧化反应,正极电极反应式为:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:Zn-2e-+2OH-=Zn(OH)2;充电为电解池反应为,该电池充电时阳极连接原电池的正极:电极反应式,Fe(OH)3-3e-+5OH-=FeO42-+4H2O;
3Zn(OH)2+2Fe(OH)3+4KOH,原电池的负极发生氧化反应,正极电极反应式为:FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:Zn-2e-+2OH-=Zn(OH)2;充电为电解池反应为,该电池充电时阳极连接原电池的正极:电极反应式,Fe(OH)3-3e-+5OH-=FeO42-+4H2O;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
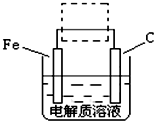 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH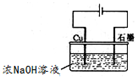 溶液的pH为
溶液的pH为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com