
组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
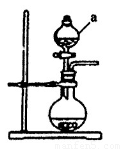
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 ????? 。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是???????????? 。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]=??? ?? 。
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。
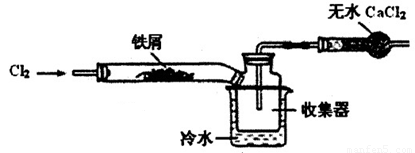
①下列操作步骤的正确排序为??????? (填字母)。
A.体系冷却后,停止通入Cl2
B.通入干燥的Cl2赶尽装置中的空气
C.在铁屑下方加热至反应完成
D.用干燥的H2赶尽Cl2
E.检验装置的气密性
②该实验装置存在的明显缺陷是????????????????? 。
(3)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
已知:NaCl+3H2O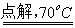 NaClO3+3H2
NaClO3+3H2 ,
,
2NaClO3+4HCl=2C1O2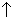 +Cl2
+Cl2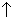 +2NaCl+2H2O。
+2NaCl+2H2O。
有关物质性质:
物质 | 熔点/℃ | 沸点/℃ |
C1O2 | -59 | 11 |
Cl2 | -107 | -34.6 |
ClO2的生产流程示意图:
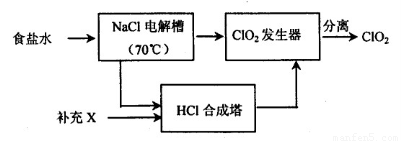
该工艺中,需要补充的物质X为??? (填化学式),能参与循环的物质是?????? (填化学式)。从ClO2发生器中分离出ClO2可采用的方法是???????????? 。
(1)分液漏斗(2分)
制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3反应产生气泡(2分)5.6×10-3(3分)
(2)①ebcad(3分)
②缺少尾气吸收装置(2分)
(3)Cl2(2分)Cl2、NaCl(2分)
将生成的气体冷水浴降温使ClO2液化分离出来(2分)
【解析】
试题分析:(1)根据实验装置图可知仪器a为分液漏斗;因为浓盐酸具有挥发性,制取的Cl2中含有HCl,HCl溶于水后能与NaHCO3反应产生CO2气体;HCO3?电离产生CO32?:HCO3? CO32?+H+,K2=[CO32?][H+]/[HCO3?]=5.6×10-11, 可得[CO32-]:[HCO3-]= K2/[H+]=5.6×10-11/10-8=5.6×10-3
CO32?+H+,K2=[CO32?][H+]/[HCO3?]=5.6×10-11, 可得[CO32-]:[HCO3-]= K2/[H+]=5.6×10-11/10-8=5.6×10-3
(2)①首先检验装置的气密性,为防止空气影响实验,通入干燥的Cl2赶尽装置中的空气,然后加热铁屑进行Fe与Cl2的反应,反应完成后,等到体系冷却后,停止通入Cl2,最后用干燥的H2赶尽Cl2,所以正确顺序为:ebcad
②尾气中含有Cl2,有毒污染环境,需要进行尾气处理,所以该实验装置存在的明显缺陷是缺少尾气吸收装置。
(3)根据题目所给信息,电解NaCl溶液和NaClO3与HCl反应的化学方程式,可知Cl2产量少,所以需要补充的物质X为为Cl2;NaClO3与HCl反应能生成Cl2和NaCl,所以能参与循环的物质是Cl2、NaCl;因为ClO2的沸点为11℃,所以将生成的气体冷水浴降温,可使使ClO2液化变为液体,分离出来。
考点:本题考查基本仪器、基本操作、实验步骤、离子浓度的计算、实验方案的设计与分析。


 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com