
| A. | 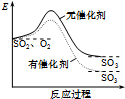 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 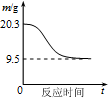 如图表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| C. | 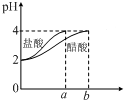 如图表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 | |
| D. | 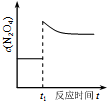 如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
分析 A、催化剂只能改变化学反应中的活化能,不能改变热效应;
B、MgCl2为强酸弱碱盐,在空气中加热发生水解生成氧化镁,据此解答即可;
C、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离;
D、此反应特点为气体体积减小的反应,缩小体积,即增大压强,平衡右移.
解答 解:A、此图中反应物总能量与生成物总能量差值出现变化,不可能是由于催化剂引起,催化剂不能改变反应的热效应,故A错误;
B、MgCl2为强酸弱碱盐,在空气中加热发生水解生成氧化镁,0.1molMgO的质量为0.1mol×(24+16)g/mol=4.0g,故最终生成质量应为4.0g,故B错误;
C、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,氯化氢是强电解质,完全电离,导致稀释过程中,醋酸中氢离子浓度大于盐酸,所以pH变化小的为醋酸,且稀释至pH=4,b应>100,故C正确;
D、此反应特点为气体体积减小的反应,缩小体积,即增大压强,平衡右移,c(N2O4)变大,与图象中先变大后变小不一致,故D错误,
故选C.
点评 本题主要考查的是化学反应的能量变化规律、弱电解质的电离、平衡移动方向判断等,综合性较强,难度较大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 仅①③④ | B. | 仅②③④ | C. | 仅①③④⑤ | D. | 仅①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙烷>乙二醇>乙醇 | |
| B. | 可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 | |
| C. | 油脂和蛋白质均为能发生水解反应的高分子化合物 | |
| D. | 聚碳酸酯 中含有 中含有 结构 结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中,c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 室温时水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存 | |
| C. | 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① | |
| D. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| B. | 氨气具有还原性,可用于检查HCl泄漏 | |
| C. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| D. | 氧化铝具有高熔点,可用于生产耐火砖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型为加聚反应.
,反应类型为加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com