
【题目】I. 已知:
反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___________,判断该反应是___________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___________,判断该反应是___________反应(填“吸热”或“放热”)。
II. T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g)![]() 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)前500s反应速率v(M)=____________,该反应的平衡常数K=_____________。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。

a.Y的逆反应速率 b.M的体积分数
c.混合气体的平均相对分子质量 d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”)。
【答案】K=K1/K2 吸热 1.8×10-3mol/(L·s) 6.75 bd ACE <
【解析】
(1)由①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
结合盖斯定律可知,①-②得到CO2(g)+H2(g)![]() CO(g)+H2O(g),且表中
CO(g)+H2O(g),且表中![]() ,可知升高温度K增大。
,可知升高温度K增大。
(2)根据速率计算公式求解;根据平衡常数定义求解;
(3)反应是正反应气体体积不变的放热反应,升温平衡逆向移动;
(4)根据反应2X(g)+Y(g)![]() 3M(g)+N(s)可知,该反应是气体体积不变的反应,若再加入3.00molM,3.00molN,折算成X、Y相当于再加入2molX和1molY,由于N是固体,N的加入对平衡没有影响,所以再加入3.00molM,3.00molN后,反应达到平衡时与原平衡为等效平衡,由于是体积为2L的恒容密闭容器,所以达到新平衡时,气体浓度为原平衡的1.5倍。
3M(g)+N(s)可知,该反应是气体体积不变的反应,若再加入3.00molM,3.00molN,折算成X、Y相当于再加入2molX和1molY,由于N是固体,N的加入对平衡没有影响,所以再加入3.00molM,3.00molN后,反应达到平衡时与原平衡为等效平衡,由于是体积为2L的恒容密闭容器,所以达到新平衡时,气体浓度为原平衡的1.5倍。
(5)若容器为绝热恒容容器,反应放出的热量使体系温度升高,平衡逆向进行;
(1)由①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
结合盖斯定律可知,①-②得到CO2(g)+H2(g)![]() CO(g)+H2O(g),则平衡常数K与K1、K2的关系式为K=K1/K2,且表中
CO(g)+H2O(g),则平衡常数K与K1、K2的关系式为K=K1/K2,且表中![]() ,可知升高温度K增大,即升高温度平衡正向移动,正反应为吸热反应。
,可知升高温度K增大,即升高温度平衡正向移动,正反应为吸热反应。
(2)前500s反应速率v(M)=3v(X)/2=![]() =1.8×10-3mol/(L·s);
=1.8×10-3mol/(L·s);
数据分析可知1000°C反应达到平衡状态,X物质的量为2mol,
2X(g)+Y(g)![]() 3M(g)+N(s)
3M(g)+N(s)
起始量(mol·L-1) 2 1 0 0
变化量(mol·L-1) 1 0.5 1.5 0.5
平衡量(mol·L-1) 1 0.5 1.5
平衡常数K=1.53/(12×0.5)=6.75。
(3)2X(g)+Y(g)![]() 3M(g)+N(s)△H<0,反应是正反应气体体积不变的放热反应,升温平衡逆向移动;
3M(g)+N(s)△H<0,反应是正反应气体体积不变的放热反应,升温平衡逆向移动;
a.图象分析可知,温度越高,平衡逆向进行,Y的逆反应速率增大,不符合图象变化,故a错误;
b.温度越高,平衡逆向进行,M的体积分数减小,图象符合,故b正确;
c.温度越高,平衡逆向进行,气体质量增大,气体的物质的量不变,混合气体的平均相对分子质量随温度升高增大,图象变化不符合,故c错误;
d.图象分析可知,温度越高,平衡逆向进行,气体总质量增大,X的质量分数减小,故d正确;
故答案为:b d;
(4)根据反应2X(g)+Y(g)![]() 3M(g)+N(s)可知,该反应是气体体积不变的反应,若再加入3.00molM,3.00molN,折算成X、Y相当于再加入2molX和1molY,由于N是固体,N的加入对平衡没有影响,所以再加入3.00molM,3.00molN后,反应达到平衡时与原平衡为等效平衡,由于是体积为2L的恒容密闭容器,所以达到新平衡时,气体浓度为原平衡的1.5倍,
3M(g)+N(s)可知,该反应是气体体积不变的反应,若再加入3.00molM,3.00molN,折算成X、Y相当于再加入2molX和1molY,由于N是固体,N的加入对平衡没有影响,所以再加入3.00molM,3.00molN后,反应达到平衡时与原平衡为等效平衡,由于是体积为2L的恒容密闭容器,所以达到新平衡时,气体浓度为原平衡的1.5倍,
A、根据上面的分析可知,两个平衡为等效平衡,故A正确;
C、根据上面的分析可知,重新达到平衡后,M的物质的量浓度是原平衡的1.5倍,故C正确,
D、由于压强增大,所以反应速率都增大,故D错误;
E、由于压强增大,用X表示的v(正)比原平衡大,故E正确;
故选ACE,
(5)若容器为绝热恒容容器,反应放出的热量使体系温度升高,平衡逆向进行,达平衡后M的物质的量浓度小于1.5mol·L-1。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是_____(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、不使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨相比较,_____填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH=_____。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为_________kJ。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1。NO分子中化学键的键能为_____。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向20mL含0.10mol·L-1Cr2+和0.10mol·L-1Fe2+的混合溶液中滴加0.10 mol·L -1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示。若溶液中金属离子浓度小于10-5mol·L-1视为完全沉淀,则下列说法错误的是
[Cr(OH)2的ksp为2×10-16,Fe(OH)2的ksp为8×10-16]

A. 曲线A表示c(Fe2+)
B. 当V(NaOH)=30mL时,Fe2+开始沉淀
C. 当pH=7时溶液中Fe2+、Cr2+均完全沉淀
D. V(NaOH)>30mL时,溶液中c(Fe2+)︰c(Cr2+) =4.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—J都是初中化学常用的物质。其中B、E、H、J是单质,其余均为化合物,气体C可用于灭火。它们相互间的转化关系如下图所示(部分反应物、生成物及反应条件已略去)。

请回答下列问题:
⑴写出物质D、J的化学式:D___________,J___________。
⑵“气体C→B”的转化过程,在自然界中称为____________作用。
⑶反应①的反应条件___________,其基本反应类型___________。
⑷写出反应②的化学方程式:______________________。
⑸若要实现“H+I→红色固体J”的转化,物质I必须满足的条件是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年地球发生地震灾害较多,抢救地震后被困在废墟下的伤员,首要的措施是给伤员补充能量。下图是医院给伤员输液时用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列的内容后填写:

(1)葡萄糖的摩尔质量为________;
(2)该溶液中含水________ g;
(3)该溶液的物质的量浓度为________ mol/L(精确到小数点后面两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素x、y、d、f的最高正价或最低负价、原子半径的相对大小随原子序数的变化如图所示;短周期元素z、e、g、h的最高价氧化物对应水化物的溶液(浓度均为001mol/L)的pH与原子序数的关系如图所示:

下列有关说法正确的是
A. 离子半径大小顺序:e>f>g>h
B. 由x、z、d三种元素形成的化合物中一定不含离子键
C. y、d、g的简单气态氢化物中沸点最高的是g的氢化物
D. 装满zd2气体的小试管倒扣水槽中充分反应,试管液面上升约2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )
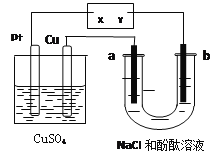
A. X是正极,Y是负极 B. U型管中溶液PH值逐渐变小
C. CuSO4溶液的pH逐渐减小 D. CuSO4溶液的pH保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com