
【题目】下列物质中既有离子键又有共价键的是( )
A. KOH B. H2O C. CaCl2 D. Cl2
科目:高中化学 来源: 题型:
【题目】火法炼汞是在不太高的温度下(450~800℃),将汞矿石或精矿进行焙烧,直接将汞还原呈气态分离出来,而后冷凝成液态汞.目前工业上制粗汞的流程如图:

下列有关说法正确的是( )
A. 流程中加入氧化钙的目的是减少SO2的排放
B. “辰砂”加热时发生反应:HgS+O2 ![]() Hg+SO2,该方法属于热分解法
Hg+SO2,该方法属于热分解法
C. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
D. 含汞烟气中汞的含量很低,可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和磷为周期表中的第VA族元素,它们的元素及其化合物在性质上既有相似性又有不同性。回答下列问题:
(1)N2分子中两个N原子都达到8电子稳定状态,则两个N原子之间共有电子的数目为____________;白磷的分子式为P4,4个P原子相互之间共形成6个共价单键,且每个P原子都达到8电子稳定状态,则白磷分子的空间构型为____________。
(2)N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式___________________________,联氨与磷酸(H3PO4)形成的磷酸二氢盐的化学方程式为_________________________________。
(3)P2O5是一种干燥剂,下列气体不能用P2O5干燥的是________(填字母序号)。
A.SO2 B.NH3 C.CO D.H2 E.H2S F.O2
(4)次磷酸(H3PO2)是一元中强酸,它的工业制法是将白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式________,Ba(H2PO2)2为_______________(填“正盐”或“酸式盐”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
A. AgNO3 B. FeCl2 C. Na2SO3 D. AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用下图装置可进行测定SO2转化成SO3转化率的实验探究:
已知:SO3的熔点是16.8℃,沸点是44.8℃。

(1)请从下图A~F装置中选择最适合装置并将其序号填入下面的空格中Ⅰ____________、Ⅱ___________、Ⅲ___________。

![]()
![]()



冰水 浓硫酸 生石灰 水 NaOH溶液 热水
A B C D E F
(2)用1mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了12.8g,则实验中SO2的转化率为_______ % 。
(3)为使SO2有较高的转化率,应均匀通入O2,,且试验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作顺序是________________;尾端球形干燥管的作用是_____________。
(4)将S02通过Na2O2粉末,完全反应后除生成O2外还生成一种白色粉末。证明该白色粉末既有Na2SO3又有Na2SO4所需的试剂是水、_______、________、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是 ( )

A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O
B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置进行相应的实验,不能达到实验目的的是( )
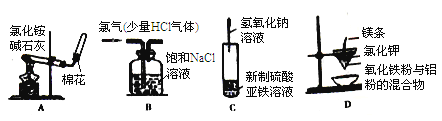
A.实验室制取并收集氨气 B.除去Cl2中的HCl气体杂质
C.实验室制取氢氧化亚铁 D.铝热反应实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲 ![]() 乙
乙 ![]() 丙.下列有关物质的推断不正确的是( )
丙.下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为AlCl3 , 则丁可能是NaOH
C.若甲为Fe,则丁可能是氯气
D.若甲为NaOH 溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
① CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③ H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____________。
(2)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图所示,则阴极的电极反应式为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com