
【题目】下列有关概念间关系的说法正确的是
A. 碱性氧化物一定是金属氧化物
B. 氧化剂在化学反应中一定被氧化
C. 酸性氧化物一定是非金属氧化物
D. 摩尔质量相同的物质其摩尔体积一定相同
科目:高中化学 来源: 题型:
【题目】下列由美国《科学》杂志评出的2008年十大科学进展中的四项研究,主要属于化学探究领域的是( )
A.观测太阳系外行星
B.绘制癌症基因图谱
C.研制高温超导材料
D.计算物质世界重量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
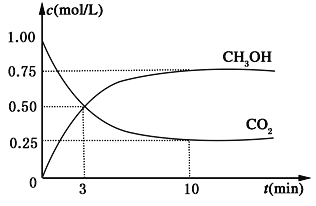
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________mol/(L·min);
(2)氢气的转化率=________________________;
(3)反应过程中,下列能说明该反应达到平衡状态的是______________________。
a.体系压强保持不变
b.混合气体密度保持不变
c.混合气体的平均相对分子质量保持不变
d.CO2的消耗速率等于CH3OH的生成速率
e.CO2与CH3OH的物质的量浓度相等
(4)该反应的平衡常数为__________________________ (保留小数点后2位);
(5)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol H2
(6)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是 ( )
A | B | C | D | |
反应 装置或 图像 |
|
|
|
|
实验现 象或图 像信息 | 温度计的 水银柱不 断上升 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 反应开始 后,针筒活 塞向右移动 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:

由图中曲线变化可知,该反应为______(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的_____。
A.△H B.E C.△H-E D.△H+E
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,下图是部分反应物随时间的变化曲线。

①10min时,v(SO3)=_____。
②反应达到平衡时,SO2的转化率为______。
③下列情况能说明该反应达到化学平衡的是_____
A. v(SO3)=v(SO2) B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变 D.混合气体的总物质的量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2) 提取铜的操作流程如图:。
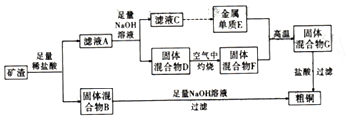
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)铁在元素周期表中的位置为___________;固体混合物B与氢氧化钠溶液反应的离子方程式为___________________。
(2)滤液A中铁元素的存在的离子形式为_______,.理由是_____________(用离子方程式表达,不必书写Cu2O 与盐酸的反应)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用多种试剂,请写出用最佳方案反应的离子方程式:_______________。
(4)工业上利用电解法进行粗铜精炼时,下列叙述正确的是______ (填序号)。
a.电解过程中,阳极质量的减轻量一定等于阴极质量的增加量
b.粗铜接电源正极,发生氧化反应
c.电解过程中,粗铜中所有杂质均被氧化
d.电解精炼过程中可以用硝酸银溶液作电解质溶液
(5)取320g固体混合物F 于硬质玻璃管中,通入足量氢气充分加热还原,固体质量减轻80g,若将所得的还原产物与足量稀盐酸反应,产生的H2在标准状况的体积为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验: 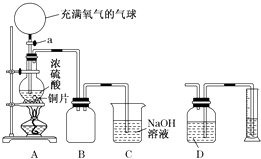
(1)先关闭活塞a,将6.4g铜片和10mL 18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失. ①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前;
打开活塞a之后 .
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整.
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计: ①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下).你认为甲学生设计的实验方案中D装置中的试剂为(填化学式).
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为mol(用含a、b的表达式来表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
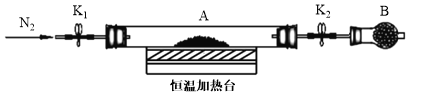
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 ________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
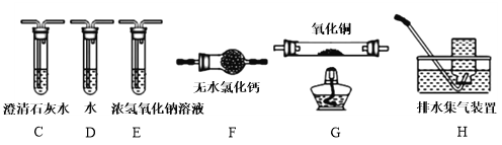
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为减少酸雨产生的途径可采取的措施是( )
①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新的能源.
A.②③
B.②③④⑤
C.①③⑤
D.①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com