
现有H2SO4、Ba(OH)2、Na2CO3和氯水4种溶液,有如图所示的相互关系,图中每条线段两端的物质可以发生化学反应。下列推断合理的是

A.M一定是Ba(OH)2
B.Y可能是氯水
C.X一定是Na2CO3溶液
D.Z可能是H2SO4
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Na+、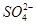 、
、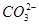
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、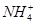 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
向含有下列各组离子的溶液中通入相应气体后,能大量共存的是
A.通入NO2:Na+、Fe2+、Cl-、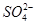
B.通入NH3: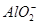 、
、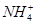 、Na+、
、Na+、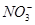
C.通入Cl2:K+、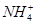 、I-、Cl-
、I-、Cl-
D.通入CO2:Na+、K+、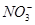 、
、
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
下列化学物质在实际生产生活和科技等方面的应用不正确的是
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是
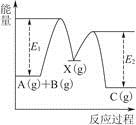
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。
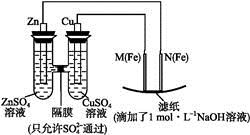
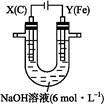
图1图2
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为 。
(3)实验过程中,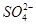 (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(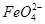 )在溶液中呈紫红色。
)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-
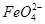 +4H2O和 。
+4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少 g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:
2K2FeO4+3Zn Fe2O3+ZnO+2K2ZnO2
Fe2O3+ZnO+2K2ZnO2
该电池正极发生的反应的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学环境污染与保护(解析版) 题型:选择题
如图是某煤发电厂处理废气的装置示意图。下列说法中错误的是
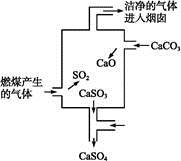
A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解和置换反应
C.整个过程的反应可表示为:2SO2+2CaCO3+O2 2CaSO4+2CO2
2CaSO4+2CO2
D.可用酸性高锰酸钾溶液检验废气处理是否达标
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
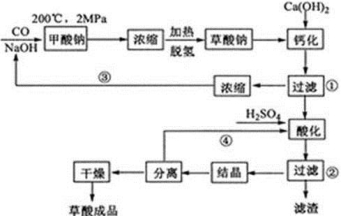
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是 和 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol/L的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com