

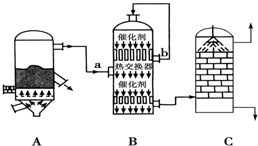
分析 (1)矿石燃烧前要粉碎成细小矿粒,增大了接触面积,加快反应速率;炉气含有大量的杂质,例如:砷、硒等的化合物和矿尘等,这些杂质把催化剂覆盖着,催化剂会失去了催化作用;
(2)根据SO2的转化率及生产成本来选择;
(3)0.12kgFeS2就会放出85kJ热量,即据1mol释放85KJ热量,据此写成热化学方程式;
(4)从C为硫酸可知,b为阴离子交换膜,故a为阳离子交换膜,在阴极区应为水放电生成氢气和氢氧根,故A为氢氧化钠;阳极应为亚硫酸根放电生成硫酸根;
(5)98%的浓H2SO4中H2SO4、H2O的物质的量之比为$\frac{98g}{98g•mo{l}^{-1}}$:$\frac{2g}{18g•mo{l}^{-1}}$=1:$\frac{1}{9}$,故98%的浓H2SO4可以表示为SO3•$\frac{10}{9}$H2O,吸收SO3后得到H2SO4•SO3,可以表示为2SO3•H2O,进一步表示为$\frac{20}{9}$SO3•$\frac{10}{9}$H2O,计算浓硫酸改写后H2O的物质的量,可得$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量,再利用硫原子守恒计算H2SO4•$\frac{1}{9}$H2O的物质的量,进而计算其质量.
解答 解:(1)工业上为了提高黄铁矿的利用率,常采取的措施是矿石燃烧前要粉碎成细小矿粒,增大了接触面积,加快反应速率;沸腾炉出来的气体含有大量的杂质,例如:砷、硒等的化合物和矿尘等,这些杂质把催化剂覆盖着,催化剂会失去了催化作用,
故答案为:矿石燃烧前要粉碎成细小矿粒,增大接触面积;防止催化剂中毒;
(2)接触室中二氧化硫与氧气反应生成三氧化硫是一个可逆反应,正方向放热,选择400℃~500℃的高温,V2O5作催化剂,原因在于此温度催化剂的活性最大,反应速率和平衡转化率都较高,如温度过高,平衡逆向移动,转化率反而降低,常压下,平衡转化率较高,如增大压强,平衡向正方向移动,理论上提高了转化率,但是会造成设备造价和耗能增加,故接触室中适宜条件是V2O5作催化剂、高温、常压,
故答案为:在其他条件具备时,二氧化硫氧化反应正向进行的限度已很高,即使增大压强,该反应的转化率升高不大,但却大大增大生产成本;
(3)0.12kgFeS2就会放出85kJ热量,即据1mol释放85KJ热量,则热化学方程式可写为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-340kJ•mol-1,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-340 kJ•mol-1;
(4)从C为硫酸可知,硫酸根来源于亚硫酸根放电.故a为阳离子交换膜,b为阴离子交换膜,在阴极区应为水放电生成氢气和氢氧根离子,故A为氢氧化钠;阳极应为亚硫酸根放电生成硫酸根,反应的离子方程式为SO32--2e-+H2O=2H++SO42-,
故答案为:阳;NaOH溶液;SO32--2e-+H2O=2H++SO42-;
(5)98%的浓H2SO4中H2SO4、H2O的物质的量之比为$\frac{98g}{98g•mo{l}^{-1}}$:$\frac{2g}{18g•mo{l}^{-1}}$=1:$\frac{1}{9}$,故98%的浓H2SO4可以表示为SO3•$\frac{10}{9}$H2O,吸收SO3后得到H2SO4•SO3,可以表示为2SO3•H2O,进一步表示为$\frac{20}{9}$SO3•$\frac{10}{9}$H2O,计算浓硫酸改写后H2O的物质的量,可得$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量,浓硫酸改写后H2O的物质的量为n(H2O)=1000g÷(80+$\frac{10}{9}$×18)×$\frac{10}{9}$=$\frac{100}{9}$mol,则$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量为10mol,根据硫原子守恒,稀释后可得浓硫酸H2SO4•$\frac{1}{9}$H2O的质量为$\frac{200}{9}$mol×(98+2)g/mol=2222g,约是2.22Kg,
故答案为:C.
点评 本题考查了工业制硫酸的生成过程和反应特征,二氧化硫的催化氧化反应的条件选择,热化学方程式的书写,电化学知识的考查,以及溶液浓度有关计算,题目过程复杂,为易错题目,关键是明确浓硫酸中水与三氧化硫反应转化为硫酸,注意理解利用改写成化学式形式结合守恒进行解答,难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
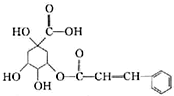
| A. | 分子式为C16H16O7 | |
| B. | 能与钠、乙醇、乙酸、溴发生反应,不能与碳酸钠发生反应 | |
| C. | 能发生取代反应、氧化反应、加成反应,不能发生水解发应 | |
| D. | 1mol 该有机物最多能与2mol NaOH或4mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 | |
| B. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 | |
| C. | 25℃下,在NH3•H2O稀溶液中,加水,$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值不变 | |
| D. | 在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加稀NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4+ |
| D | 将0.1mol•L-1MgSO4溶液滴入到NaOH溶液里至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的Ksp小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
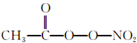 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
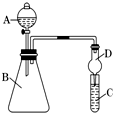 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
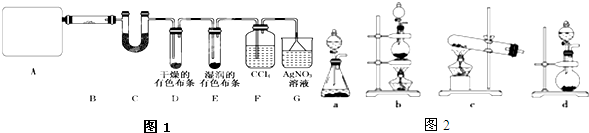
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
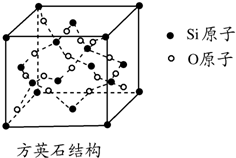 二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )
二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )| A. | 方英石晶体中存在着SiO4结构单元 | |
| B. | 1 mol Si形成2 mol Si-O键 | |
| C. | 上图所示的结构单元中实际占有18个硅原子 | |
| D. | 方英石晶体中,Si-O键之间的夹角为90° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com