
| A. | 溴苯(溴) 加氢氧化钠再分液 | B. | 乙酸(乙醇)用蒸馏 | ||
| C. | 乙酸乙酯(乙酸)直接分液 | D. | 乙烷(乙烯)用酸性高锰酸钾溶液 |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
 苹果酸是一种常见的有机酸,其结构简式如图所示:
苹果酸是一种常见的有机酸,其结构简式如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (4c-b+2c)kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Fe与少量氯气反应时转移的电子数为2NA | |
| B. | 0.2 mol S在空气中充分燃烧,转移电子数为0.6NA | |
| C. | 0.1molCl2溶于水中发生反应,转移电子数为0.1NA | |
| D. | 1.5 mol Na2O2与足量的二氧化碳充分反应,转移电子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
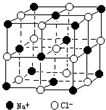 (1)熔点沸点HF>HI;原因:HF分子间含有氢键
(1)熔点沸点HF>HI;原因:HF分子间含有氢键查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| B. | 反应②中,1mol葡萄糖可生成3mol乙醇 | |
| C. | 将在空气中灼绕后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应①中,(C6H10O5)n可表示淀粉或纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 控制塑料购物袋的使用主要是为了节约成本 | |
| B. | 使用可降解塑料袋有利于减少“白色污染” | |
| C. | 聚氯乙烯塑料袋可用来长时间存放食品 | |
| D. | 塑料购物袋具有热固性,不能回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
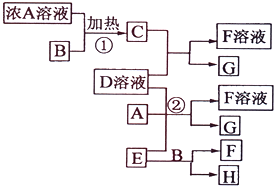 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{1000wρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | w=$\frac{cM}{1000ρ}$% | D. | c=$\frac{m}{VM}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com