
Ⅰ. 固体氧化物燃料电池(SOFC)以固体氧化物作为
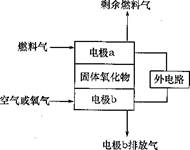 电解质介质,其工作原理如图所示。
电解质介质,其工作原理如图所示。
(1)电极b的电极反应式是
(2)假设外电路是电解硫酸铜溶液的装置。
若以C2H4为燃料气,工作一段时间后
燃料电池中消耗了标准状况下的2.24LC2H4,
则外电路阴极区的产物及其物质的量分别
是 。
Ⅱ.下列试剂均可用于除去NaCl溶液中混有
的少量Na2S。
A. CaCl2 B.AgCl C.HCl
(1)最好的试剂是 (填写序号字母)。
写出加人该试剂时反应的离子方程式 。
(2)选用另外两种试剂实验时存在缺陷,简叙其主要缺陷:
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
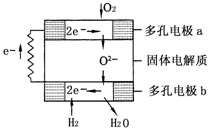 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1,| 化学键 | C-O | C-H | H-H | C≡O | O-H |
| 键能 kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol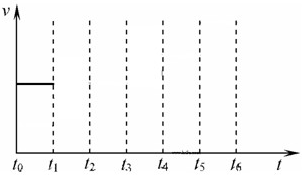 在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在熔融电解质中,O2-由负极移向正极 | B、通甲烷的电极为电池的正极 | C、负极的电极反应方程式为:CH4+4O2--8e-?CO2+2H2O | D、电路中每流过1mol电子,约有5.6L甲烷被完全氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com