
【题目】某烃的含氧衍生物可以作为无铅汽油的抗爆震剂,它的相对分子质量不超过100,含C的质量分数为68.2%,含H的质量分数为13.6%,其余为氧。请计算回答:
(1)该化合物的相对分子质量是____________________。
(2)写出该化合物的分子式___________________________。
(3)若该化合物不能与钠反应产生氢气,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。_________________________________
科目:高中化学 来源: 题型:
【题目】Ⅰ.将等质量的锌片和铜片用导线相连插入500 mL CuSO4溶液中构成如图所示的装置。
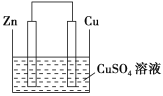
(1)该装置为____装置,该装置中发生反应的总离子方程式为____,铜片周围溶液会出现________的现象。
(2)若2 min后测得锌片的质量减少1.3 g,则导线中流过的电子为_____mol。
(3)若该装置的电解质溶液换为FeCl3溶液,其正极反应为_______。
Ⅱ.向2L密闭容器中通入amol气体A和b mol气体B,在一定条件下发生反应xA(g)+yB(g)![]() pC(g)+qD(g)。已知:平均反应速率v(C)=
pC(g)+qD(g)。已知:平均反应速率v(C)=![]() v(A);反应至2min时,A的物质的量减少了
v(A);反应至2min时,A的物质的量减少了![]() ,B的浓度减少了
,B的浓度减少了![]() amol/L,同时有amolD生成。
amol/L,同时有amolD生成。
(4)0~2 min内,v(A)=__________。
(5)该化学方程式中,y=__________。
(6)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率____(填“增大”、“减小”或“不变”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
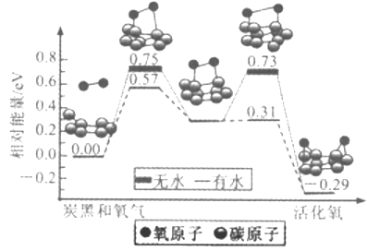
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂,下面是部分环烷烃及烷烃衍生物的 结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)。

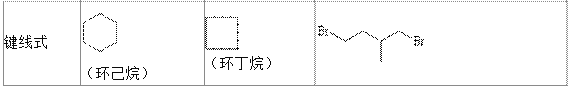
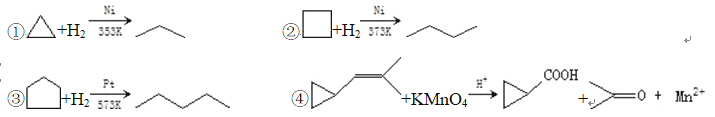
回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是____________(填名称)。判断依 据为____________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条件下反 应,其化学方程式为____________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法.试剂____________;现象与结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,化学式可表示为[Fea(OH)b(SO4)c]m,取其与足量盐酸反应,所得溶液平均分为两份,一份溶液加入足量的BaCl2溶液,得到沉淀4.66 g。另一份溶液,加入足量的NaOH溶液后过滤,对滤出固体洗涤,后灼烧得到红棕色固体质量为1.6 g,该聚合硫酸铁样品中a∶b的比值是
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学品要在包装上印上警示性标志,下列化学品的名称与警示性标志名称对应正确的是
A. 烧碱——爆炸品 B. 浓硫酸——剧毒品
C. 汽油——腐蚀品 D. 酒精——易燃品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30 mL 0.5 mol·L-1NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为
A. 0.3 mol·L-1 B. 0.03 mol·L-1 C. 0.05 mol·L-1 D. 0.04 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金(质量为m g)投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是
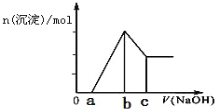
A. 假设a=25,整个反应过程中,主要发生了6个离子反应
B. c值越大,合金中Mg的含量越高
C. b值越大,合金中Al的含量越高
D. 根据图象判断,镁铝合金与50mL1mol/L的HCl溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是制备氯气并进行一系列相关实验的装置(有些夹持设备已略)。
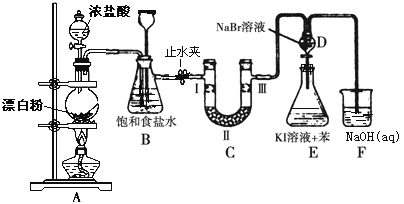
(1)写出A装置生成氯气的化学反应方程式____________________________。
(2)装置B除及吸收HCl外还有两个作用, 请写出: _________________,________________。
(3)装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号 | 1 | 2 | 3 | 4 |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 硅胶 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______________________该现象_______(填“能”或“不能”)说明溴的非金属性强于碘,原因是____________________。
(5)有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com