
【题目】某含氧有机化合物X,其相对分子质谞为46,其中碳元素的质量分数为52.2%,氢元素的质量分数为13.0%。 X可与金属钠反应放出氢气。请回答下列问题:
(1)X的结构简式为________。
(2)X与酸性K2Cr2O7溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若120 g X和150 g Z反应能生成106 g W,计算该反应的产率__________ (产率=实际产量/理论产量×100%,结果保留到小数点后一位)。
【答案】 CH3CH2OH 48.2%
【解析】分析:根据题意知氧的质量分数为1-52.2%-13.0%=34.8%,则碳、氢、氧原子的个数分别为:![]() ,
,![]() ,
,![]() ,
,
则X的分子式为C2H6O,乙醇含官能团羟基,故和钠反应产生氢气,催化氧化生成乙醛。乙醇被酸性K2Cr2O7溶液氧化可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,乙酸与乙醇发生酯化反应生成W为乙酸乙酯,据此解答。
详解:(1) 根据题意知氧的质量分数为1-52.2%-13.0%=34.8%,则碳、氢、氧原子的个数分
![]() ,
,![]() ,
,![]() ,
,
则X的分子式为C2H6O,因能与钠反应生成H2,所以X为乙醇,结构简式为:CH3CH2OH,因此,本题正确答案是:CH3CH2OH;
(2)乙醇与K2Cr2O7酸性溶液反应可生成乙酸。在加热和浓硫酸作用下,乙酸与乙醇反应可生成一种有香味的物质乙酸乙酯,该反应的化学方程式为: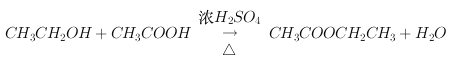
46g 60g 88g
由方程式可以知道,乙醇过量,按乙酸计算,150g乙酸理论上产生乙酸乙酯为:![]() ×150g=220g,故该反应产率为:
×150g=220g,故该反应产率为:![]() ×100%=48.2%,答:该反应产率为48.2%。
×100%=48.2%,答:该反应产率为48.2%。


科目:高中化学 来源: 题型:
【题目】3,4-二羟基肉桂酸(H)是为止血升白细胞药,用于肿瘤治疗的术后恢复,其合成路线如图所示。

已知:
请回答下列问题:
(1)X的名称为_______________,A中的官能团的名称是____________。
(2)Y+R→Z的化学方程式为____________。反应类型为____________。
(3)下列说法正确的是____________ (填字母)。
a.1 molH最多能和3 mol Br2反应
b.1个H分子中最多有8个碳原子共平面
c.乙烯在一定条件下与水发生加成反应生成X
d.有机物Z的分子式为C9H8O2Cl2
(4)T是H的芳香族同分异构体,1mol T与足量碳酸氢钠溶液反应生成2mol CO2,则T的结构有____________种。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为____________ (写一种即可)。
(5)设计以甲醛、Y为原料合成C5H12O4 ( )的路线 (无机试剂任选) 。____________
)的路线 (无机试剂任选) 。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钌(Ru)是一种硬而脆的多价稀有金属,性质很稳定。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法不正确的是

A. 加热试管前,应先收集气体并点燃,通过爆鸣声判断气体的纯度
B. 洗气瓶中盛装的可能是NaOH 溶液,用于除去HCl
C. 结束反应时,先关闭活塞K,再停止加热
D. 启普发生器不可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、M均为中学化学中的常见物质,A~D含有相同元素。其转化关系如下:
![]()
请回答:
(1)若A为淡黄色固体单质。
①A元素在周期表中的位置是_____。
②下列叙述正确的是_____(填字母序号)。
a.B属于大气污染物,是导致酸雨的重要原因之一
b.C可以与CaO反应生成CaSO3
c.D的浓溶液可以在加热条件下与金属Cu反应生成B
(2)若A为能使湿润红色石蕊试纸变蓝的气体。
①写出C→D的化学方程式:_____________________。
②A与C反应生成一种空气中含量最多的气体E,若该反应中转移6mol电子,则生成的E在标准状况下的体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.反应Fe+H2S04=FeS04+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”)。铜片上产生的现象为_____________,该极上发生的电极反应为____________,
II.在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)=3C(g)+nD(g),开始时 A为4mol, B为6 mol, 5min末时测得C的物质的量为3mol,用D表示的化学反应速率![]() (D)为 0.2 mol/(Lmin).
(D)为 0.2 mol/(Lmin).
计算:
(1)5 min末A的物质的量浓度为_________。
(2)前5 min 内用B表示的化学反应速率![]() (B))为__________。
(B))为__________。
(3)化学方程式中n的值为_________。
(4)此反应在四种不同情况下的反应速率分别为:

其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.得到的废液中含有Fe2+、Cu2+、Fe3+和Cl﹣.为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(1)FeCl3溶液和铜反应的离子方程式为__。
(2)上述方框内物质A和X的化学式:A__,X__。上述流程中有关Fe2+和Fe3+相互转化的离子方程式是__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的是( )
①C(s)+ ![]() O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
②S(g)+O2(g)═SO2(g);△H3 S(s)+O2(g)═SO2(g);△H4
③CaO(s)+H2O(l)═Ca(OH)2(s);△H5 CaCO3(s)═CaO(s)+CO2(g);△H6 .
A.②
B.①②
C.①③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A焰色反应为黄色,B的一价阴离子的电子层结构与氩相同,请回答:
(1)元素符号:A___________,B___________;
(2)元素B的离子结构示意图为__________,B的单质常温下是____态
(3)A和B形成的化合物的化学式是___________,该化学式_________(选填“能”或“不能”)称为分子式,它是通过_________键形成的,属于_________化合物(选填“离子”或“共价”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com