
用一定浓度的NaOH标准溶液分别中和相同体积和相同pH值的两种酸溶液:![]() (一元弱酸,电离度1.0%)、
(一元弱酸,电离度1.0%)、![]() (一元强酸),则所需NaOH溶液体积比(
(一元强酸),则所需NaOH溶液体积比(![]() ∶
∶![]() )
)
[ ]
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解

| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | |
| 沸点℃ | 110.8 | 97.2 | 71 | |
| 物质 | 对溴甲苯 | 邻溴甲苯 | ||
| 沸点℃ | 184.3 | 181.7 | ||
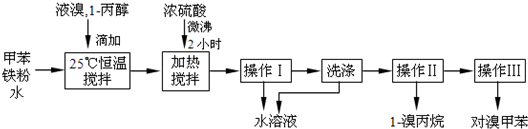
查看答案和解析>>
科目:高中化学 来源: 题型:
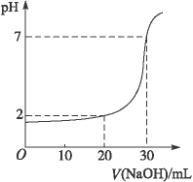
| A | B | C | D |
| 0.12 | 0.04 | 0.03 | 0.09 |
| 0.04 | 0.12 | 0.09 | 0.03 |
查看答案和解析>>
科目:高中化学 来源:2014届湖北省新高三起点调研化学试卷(解析版) 题型:选择题
25℃时,下列说法正确的是
A.pH =8.3的NaHCO3溶液:c( Na+)>c( HC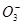 )>c(C
)>c(C 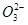 )>c( H2CO3)
)>c( H2CO3)
B.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同
C.用一定浓度的NaOH溶液滴定氢氟酸,当pH =6时,溶液中c(F—)—c(Na+)=9.9×l0—7 mol/L
D.用NaOH溶液滴定HCI与CH3COOH的混合溶液至中性时,溶液中的酸被完全中和
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二下学期期中考试化学试卷 题型:填空题
20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示。(体积变化忽略不计)
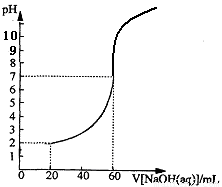
(1)X、Y的物质的量浓度之比为
(2)盐酸的物质的量浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com