
(08上海12校第二次联考)(A)课外活动中做乙醛被空气氧化生成乙酸的实验,
有同学设计了下图实验装置进行,在B试管中加入
10ml 40%的乙醛水溶液、5g醋酸锰晶体和沸石的混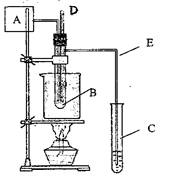
合物,在烧杯中加50ml的硅油,在C试管中加入
10ml蒸馏水。
已知相关物质的沸点如下表:
物质 | 乙醛 | 乙酸 | 硅油 | 水 | 植物油 |
沸点 | 20.8℃ | 117.9℃ | 180℃以上 | 100℃ | 175℃ |
当温度计的读数为60℃―80℃时在A处鼓入空气10―15次,
继续加热,最终在试管C中得到的水溶液为乙酸溶液。请回答下列问题:
(1)写出上述方法制取乙酸的化学方程式 。
(2)在烧杯中放硅油的原因是 ,
为了保证实验的成功,在烧杯中也可以用 代替硅油。在鼓入空气前后 的温度计水银球的位置是:鼓入前 鼓入后: ,最后温度应控制在 。
(3)对C试管中收集到的水溶液检验的常见方法是:
① 。
② 。
③ 。
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
(08上海12校第二次联考)有55.29g碳酸钾和氯化钙的混合物,在40℃将其加入一定量的水中,碳酸钾和氯化钙刚好完全反应并得到氯化钾的饱和溶液。在该温度下过滤(假定过滤时无损耗),得到104.3g滤液,将滤渣干燥后称量为22.9g。求:
(1)原混合物中碳酸钾的含量分数;
(2)40℃氯化钾的溶解度。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海12校第二次联考)合成氨的反应在一定条件下已达到平衡状态:N2+3H2 ![]() 2NH3+Q。
2NH3+Q。
(1)用氢气表示正反速率,氨气表示逆反应速率,两者的关系式为 。
(2)若降低温度,V正 (填增大、不变、减小),平衡向 移动,若生成每摩尔氨气的反应热是46.2千焦,则上述反应的热化学方程式为 。
(3)若增加氢气的浓度,氮气的转化率 ;若将氨分离出来,化学平衡常数 。
(填增大、减小、不变)
(4)请在右图定性表示H2的逆反应速率
变化与时间的关系图象,相应的变化特点为:t1达平衡、t2降温、t3又达平衡、t4增压、t5再次达平衡。

查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海12校第二次联考)关于胶体和溶液的区别,下列叙述中正确的是 ( )
A.溶液呈电中性,胶体带电荷
B.溶液中溶质微粒不带电,胶体中分散质微粒带有电荷
C.通电后,溶液中分散质微粒分别向两极运动,胶体中分散质微粒向某一极移动
D.溶液与胶体的本质区别在于分散质微粒直径大小,前者小于1纳米,后者介于1―100纳米之间
查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海12校第二次联考)在化工生产中,硝酸的制备通常采用催化氧化法,原料主要是氨气和氧气。
问题1:由于二氧化碳不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失)。
(1)从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为 。
(2)如果按理论上的原料将原料放在一个具有反应条件下的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为 。
(3)循环操作的次数与二氧化氮在生成硝酸的转化率具有一定的数学关系。计算一定量的二氧化氮气体大约要经过 次循环操作,才能使二氧化氮的转化率约为96%。
问题2:将上述方法制得的硝酸,可以稀释成浓缩得各种不同浓度的硝酸。大量实验证明,同一金属与不同浓度的硝酸反应可生成不同的还原产物。某研究小组实验研究了镁与不同浓度硝酸反应,测得气体产物主要有H2、N2、NO、NO2,溶液中的产物主要有Mg(NO3)2、NH4NO3、H2O。
(4)现有0.96Mg与足量浓度为4mol/l的HNO3完全
反应,收集到224ml(S.T.P)气体,各气体产物

成分和所有硝酸浓度曲线如右图所示。通过计
算确定还原产物的组成及各成分的物质的量之
比是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海12校第二次联考)X、Y、Z是三种常见元素的单质,甲乙是两种常见
的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是 () 
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为金属单质,则Z必为非金属单质
D.如果X、Y都为非金属单质,则Z必为金属单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com