
| 1 |
| 12 |
| m |
| M |
| m |
| M |
 ;O3和O2都由同种氧原子构成,二者质量相等,含有氧原子数目相等,即含有氧原子数目之比为1:1,
;O3和O2都由同种氧原子构成,二者质量相等,含有氧原子数目相等,即含有氧原子数目之比为1:1, ;1:1;
;1:1;| ag | ||
|
| 12a |
| b |
| mg | ||
|
| bm |
| 12a |
| mg |
| aNAg/mol |
| m |
| aNA |
| 12a |
| b |
| bm |
| 12a |
| m |
| aNA |
| 0.4mol |
| 2 |
| 19g |
| 0.2mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B、由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D、由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol |
| B、3 mol |
| C、2.25mol |
| D、2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中的①、②、③、④分别是几种常见漏斗的上部,A、B、C、D分别是实际操作时,各漏斗的下部插入容器的示意图.请根据实际使用操作时上述漏斗的使用范围和它们形状,指出①、②、③、④分别与A、B、C、D中的哪一种或几种相匹配?
如图中的①、②、③、④分别是几种常见漏斗的上部,A、B、C、D分别是实际操作时,各漏斗的下部插入容器的示意图.请根据实际使用操作时上述漏斗的使用范围和它们形状,指出①、②、③、④分别与A、B、C、D中的哪一种或几种相匹配?查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
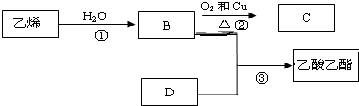 已知各物质能发生以下转化,根据框图回答:
已知各物质能发生以下转化,根据框图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com