

分析 (1)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol;
②Fe(NO3)3被NaClO氧化成Na2FeO4;结晶过程中钾离子和高铁酸根离子反应生成高铁酸钾沉淀;
(2)①温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
②pH越小,氢离子浓度越大,然后根据平衡移动解题.
解答 解:(1)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol,
故答案为:10;
②Fe(NO3)3被NaClO氧化成Na2FeO4,其反应的化学方程式为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;结晶过程中反应的离子方程式为2K++FeO42-=K2FeO4↓,
故答案为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;2K++FeO42-=K2FeO4↓;
(2)①由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,所以K2FeO4的稳定性随着温度的升高而减弱,
故答案为:K2FeO4的稳定性随着温度的升高而减弱;
②pH越小,氢离子浓度越大,由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小,由图知a<c,
故答案为:<;由4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑可知:氢离子浓度增大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,pH越小.
点评 本题考查学生阅读题目获取信息的能力、铁的化合物的性质、氧化还原反应、化学平衡移动等,题目难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.


科目:高中化学 来源: 题型:多选题
| A. | 1:3 | B. | 5:1 | C. | 1:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
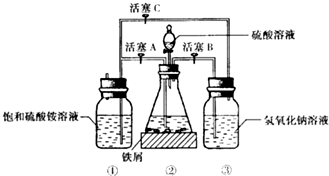 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH被还原 | |
| B. | NaH体现氧化性 | |
| C. | H2O既不是氧化剂又不是还原剂 | |
| D. | 若生成22.4 L标准状况下的H2,则有1 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com